��Ŀ����
����Ŀ����һ��ij��Һ�п��ܺ���Fe2����Mg2����Cu2����NH4����Al3���е�һ�ֻ��֡�������һ�ֵ���ɫ���岢������Һʱ���д̼�������ų��Ͱ�ɫ�������ɣ����뵭��ɫ��������ʵ����������꣩�����������Ͳ�����������ʵ����������꣩�Ĺ�ϵ������ͼ1��ʾ������д���пհף�
��1���ڸ���Һ�к��е�������_____________�����ʵ���Ũ��֮��Ϊ_______________��
��2�����ӵĵ���ɫ������________________����ѧʽ����

������������ʯ����Ҫ�ɷ�ΪFeS2������FeS���������������в���Fe��SԪ�أ��Ҹ����²�������ѧ�仯�������ҹ���������᳧��ȡ�������Ҫԭ�ϡ�ij��ѧ��ȤС��Ըû�����ʯ��������ʵ��̽������m1 g�û�����ʯ����Ʒ������ͼ2װ�ã��гֺͼ���װ���ԣ���ʯӢ���У���a�����ϵػ���ͨ��������������ջ�������Ʒ����Ӧ��ȫ���䷴Ӧ�Ļ�ѧ����ʽΪ��![]()
��ʵ��һ�����ⶨ��Ԫ�صĺ���
��Ӧ��������ƿ�е���Һ�������´�����

��3����Ӧ��������ƿ�е���Һ�������H2O2��Һ��Ŀ���ǣ��û�ѧ����ʽ��ʾ��________________________________________��
��4���û�����ʯ����Ԫ�ص���������Ϊ______________���г�����ʽ���ɣ���
��ʵ��������ⶨ��Ԫ�صĺ���

��5�����У���Ҫ�õ����������ձ�������������ͷ�ι��⣬����_________________��
��6��ijͬѧһ�����������εζ�ʵ�飬ʵ������¼���£�
ʵ����� | ��һ�� | �ڶ��� | ������ |
����KMnO4��Һ���/mL | 25.00 | 25.03 | 24.97 |
�����������ݣ������ϡ��Һ��Fe2+�����ʵ���Ũ��Ϊc(Fe2+) ��_______________��
���𰸡� Mg2����Al3����NH4�� 1��1��3 Na2O2 Na2SO3+H2O2=Na2SO4+H2O 32m2/233m1��100% 250mL����ƿ 0.5mol/L
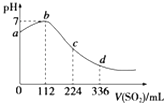
����������һ������ɫ���������Һ�У���������Һʱ���д̼�������ų��Ͱ�ɫ�������ɣ���ɫ����ΪNa2O2��ͼ��ʵ��Ϊ����ͼ����һ�������һ�����������壬�����һ�������dz�����ͼ���м���8mol�������ƺ�����С����û����ȫ�ܽ⣬����Һ��һ��û��Fe2����Cu2����һ����NH4����Al3����Mg2��������8mol��������֮�����������С���ʼ���8mol��������ʱ��笠�������ȫ��Ӧ��
��1���ڸ���Һ�к��е������� Mg2����Al3����NH4�� ; ���������֪��n��Mg2����=n[Mg��OH��2]=2mol��n��Al3����=4mol-n[Mg(OH)2]=2mol����n��Na2O2��=8molʱ����2Na2O2+2H2O=4NaOH+O2������֪n��O2��=8mol��1/2=4mol������n��NH4����=n��NH3��=10mol-n��O2��=6mol����n��Mg2������n��Al3������n��NH4����=2mol��2mol��6mol=1��1��3; (2)����ɫ����ΪNa2O2��
��������3����Ӧ��������ƿ�е���Һ�������H2O2��Һ��Ŀ���ǣ�Ϊʹ�������������ȫת��Ϊ��������ӣ������˫��ˮҪ�����������ķ�Ӧ�Ļ�ѧ����ʽΪ��Na2SO3+H2O2=Na2SO4+H2O��
(4)�������ó��������ᱵ��������ԭ���غ��������������������Ϊx��
S������BaSO4
32g 233g
x m2g
x=32m 2/233g
��������=![]()
��5��������У�һ�����ʵ���Ũ����Һ�������У������ձ�������������ͷ�ι��⣬����Ҫ250mL����ƿ��
��6��������ζ������и��������Һƽ���������=![]() =25mL��
=25mL��
������ԭ��ӦΪ��5Fe2��+MnO4��+8H��=Mn2��+5Fe3��+4H2O���������������ʵ���Ϊn����
5Fe2��+MnO4��+8H��=Mn2��+5Fe3��+4H2O
5 1
n 0.1mol��L��1��0.025L
n=0.0125mol��
c��Fe2����=![]() =0.5000mol��L��1��
=0.5000mol��L��1��