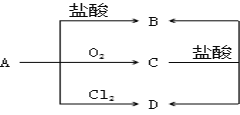
题目内容
【题目】下列热化学方程式或叙述正确的是( )
A.1 mol液态肼在足量氧气中完全燃烧生成水蒸气,放出642kJ的热量:N2H4(l)+O2(g)═N2(g)+2H2O(g)△H=+642 kJ?mol﹣1
B.12 g石墨转化为CO时,放出110.5 kJ的热量:2C(石墨,s)+O2(g)═2CO(g)△H=﹣110.5 kJ?mol﹣1
C.已知:H2(g)+ ![]() O2(g)═H2O(l)△H=﹣286 kJ?mol﹣1 , 则:2H2O(l)═2H2(g)+O2(g)的△H=+572 kJ?mol﹣1
O2(g)═H2O(l)△H=﹣286 kJ?mol﹣1 , 则:2H2O(l)═2H2(g)+O2(g)的△H=+572 kJ?mol﹣1
D.已知N2(g)+3H2(g)?2NH3(g)△H=﹣92.4 kJ?mol﹣1 , 则在一定条件下向密闭容器中充入0.5 mol N2(g)和1.5 mol H2(g)充分反应放出46.2 kJ的热量
【答案】C
【解析】解:A.燃烧反应的反应热为负值,1 mol液态肼在足量氧气中完全燃烧生成水蒸气,放出642kJ的热量:N2H4(l)+O2(g)═N2(g)+2H2O(g)△H=﹣642 kJmol﹣1 , 故A错误; B.12 g石墨转化为CO时,放出110.5 kJ的热量,则2mol石墨转化为CO放出221kJ热量,所以2C(石墨,s)+O2(g)═2CO(g)△H=﹣221 kJmol﹣1 , 故B错误;
C.反应热与方程式的计量数成正比,方程式反写时,反应热的符号相反,已知:H2(g)+ ![]() O2(g)═H2O(l)△H=﹣286 kJmol﹣1 , 则:2H2O(l)═2H2(g)+O2(g)的△H=+572 kJmol﹣1 , 故C正确;
O2(g)═H2O(l)△H=﹣286 kJmol﹣1 , 则:2H2O(l)═2H2(g)+O2(g)的△H=+572 kJmol﹣1 , 故C正确;
D.已知N2(g)+3H2(g)2NH3(g)△H=﹣92.4 kJmol﹣1 , 该反应为可逆反应,氮气和氢气不能全部转化为氨气,所以在一定条件下向密闭容器中充入0.5 mol N2(g)和1.5 mol H2(g)充分反应放出热量小于46.2 kJ,故D错误.
故选C.

【题目】五种短周期元素D,E,F,X,Y,Z的原子序数依次增大,D,E两元素最高正价与最低负价之和均为0,E元素的一种同位素常用于考古断代,D和X同主族,F和Y同主族,F的多种化合物可用作化肥,豆科植物的根瘤菌可将其单质转化为化合物,X和Z形成的二元化合物是厨房常用的调味品.回答下列问题:
①E元素在元素周期表中的位置是 .
②由D和F,Y,Z所形成的最简单常见共价型化合物中,还原性最强的是(用化学式表示).
③F,X,Z形成的简单离子半径从大到小顺序为(用离子符号表示).
④X与Z能形成一种离子化合物,用电子式表示其形成过程: .
⑤2012年,罗马大学科学家制造出F4分子,则F4和F2两种单质的关系是 .
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.01 | 0.008 | 0.007 | 0.007 | 0.007 |