题目内容
10.如图是元素周期表的一部分:
(1)请在表中画出金属与非金属的交界线.
(2)请在表中用阴影标出第VIII族的位置.
(3)在表中标出${\;}_{22}^{48}$Ti的位置.
分析 (1)金属元素原子最外层电子数≤电子层数;
(2)周期表中第8、9、10三列为VIII族;
(3)4822Ti为22号元素,处于周期表中第三周期第4列.
解答 解:(1)金属元素原子最外层电子数≤电子层数;
(2)周期表中第8、9、10三列为VIII族;
(3)4822Ti为22号元素,处于周期表中第三周期第4列,
金属与非金属交界线、VIII族位置、4822Ti如图: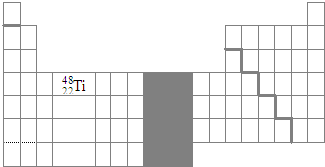 ,
,
故答案为: .
.
点评 本题考查元素周期表结构,难度不大,注意周期表中列与族的关系.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案
相关题目
15. 如图所示,已知两瓶容积相同,同温同压下,左瓶内充满氯化氢气体,当右瓶中充满下列混合气体中的某一组时,其所含原子总数与左瓶中所含原子总数一定相等,则该混合气体是( )
如图所示,已知两瓶容积相同,同温同压下,左瓶内充满氯化氢气体,当右瓶中充满下列混合气体中的某一组时,其所含原子总数与左瓶中所含原子总数一定相等,则该混合气体是( )
 如图所示,已知两瓶容积相同,同温同压下,左瓶内充满氯化氢气体,当右瓶中充满下列混合气体中的某一组时,其所含原子总数与左瓶中所含原子总数一定相等,则该混合气体是( )
如图所示,已知两瓶容积相同,同温同压下,左瓶内充满氯化氢气体,当右瓶中充满下列混合气体中的某一组时,其所含原子总数与左瓶中所含原子总数一定相等,则该混合气体是( )| A. | O3、N2 | B. | CH4、NH3 | C. | N2、O2 | D. | CO、CO2 |
5.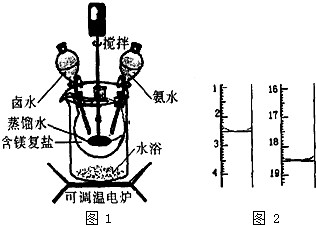 碱式碳酸镁密度小,是橡胶制品的优良填料.可用复盐MgCO3•(NH4)2CO3•H2O作原料制各.取一定量的含镁复盐放三颈烧瓶中,并将三颈烧瓶放在恒温水浴锅中加热(如图1所示),按一定的液固比加入蒸馏水,开启搅拌器同时加入预定的氨水,待温度到达40℃时开始热解,此时滴加卤水(氯化镁溶液)并继续滴入氨水,保持10min时间后过滤洗涤,滤出的固体在120℃的温度条件下干燥得到碱式碳酸镁产品.
碱式碳酸镁密度小,是橡胶制品的优良填料.可用复盐MgCO3•(NH4)2CO3•H2O作原料制各.取一定量的含镁复盐放三颈烧瓶中,并将三颈烧瓶放在恒温水浴锅中加热(如图1所示),按一定的液固比加入蒸馏水,开启搅拌器同时加入预定的氨水,待温度到达40℃时开始热解,此时滴加卤水(氯化镁溶液)并继续滴入氨水,保持10min时间后过滤洗涤,滤出的固体在120℃的温度条件下干燥得到碱式碳酸镁产品.
(1)本实验选择水浴加热方式,其优点是使反应物受热均匀,温度容易控制.
(2)40℃时复盐开始热解生成MgCO3•3H2O,并有气体产生,该反应的化学方程式为MgCO3•(NH4)2CO3•H2O+H2O$\frac{\underline{\;\;△\;\;}}{\;}$MgCO3•3H2O+2NH3↑+CO2↑.
(3)碱式碳酸镁产品中镁的质量分数[w(Mg)%]越高,产品质最越好,氯的质量分数越高,产品质量越差.某科研小组用沉淀滴定法分析产品中C1-的含量,称取6.1000g产品用适量硝酸溶解,经稀释等步骤最终配得500mL的溶液.①在配制过程中必需要用到的一种计量仪器是电子天平或分析天平.准确最取25.00mL待测液,用硝酸银标准液进行滴定,滴定前后滴定管中的液面读数如图2所示,则滴定过程中消耗标准液的体积为16mL.
②已知某温度时,一些银盐的颜色和Ksp如下表:
则滴定时,可用作指示剂的是d.
a.CaCl2b.NaBr c.NaI d.K2CrO4
③滴定时,应将溶液调成中性,不能是强酸性或强碱性,其中不能是强碱性的原因是碱性条件下,硝酸银会生成氢氧化银或氧化银沉淀.
(4)已知制得的碱式碳酸镁可表示为xMgC03′yMg(OH)2H2O.若碱式碳酸镁的质量ag(不考虑微最杂质),充分灼烧后,测得剩余固体的质量为bg,产生的二氧他碳气体体积在标准状况下为cL,则碱式碳酸镁中x:y=40c:(22.4b-40c).(用b、c表示,不需化简)
 碱式碳酸镁密度小,是橡胶制品的优良填料.可用复盐MgCO3•(NH4)2CO3•H2O作原料制各.取一定量的含镁复盐放三颈烧瓶中,并将三颈烧瓶放在恒温水浴锅中加热(如图1所示),按一定的液固比加入蒸馏水,开启搅拌器同时加入预定的氨水,待温度到达40℃时开始热解,此时滴加卤水(氯化镁溶液)并继续滴入氨水,保持10min时间后过滤洗涤,滤出的固体在120℃的温度条件下干燥得到碱式碳酸镁产品.
碱式碳酸镁密度小,是橡胶制品的优良填料.可用复盐MgCO3•(NH4)2CO3•H2O作原料制各.取一定量的含镁复盐放三颈烧瓶中,并将三颈烧瓶放在恒温水浴锅中加热(如图1所示),按一定的液固比加入蒸馏水,开启搅拌器同时加入预定的氨水,待温度到达40℃时开始热解,此时滴加卤水(氯化镁溶液)并继续滴入氨水,保持10min时间后过滤洗涤,滤出的固体在120℃的温度条件下干燥得到碱式碳酸镁产品.(1)本实验选择水浴加热方式,其优点是使反应物受热均匀,温度容易控制.
(2)40℃时复盐开始热解生成MgCO3•3H2O,并有气体产生,该反应的化学方程式为MgCO3•(NH4)2CO3•H2O+H2O$\frac{\underline{\;\;△\;\;}}{\;}$MgCO3•3H2O+2NH3↑+CO2↑.
(3)碱式碳酸镁产品中镁的质量分数[w(Mg)%]越高,产品质最越好,氯的质量分数越高,产品质量越差.某科研小组用沉淀滴定法分析产品中C1-的含量,称取6.1000g产品用适量硝酸溶解,经稀释等步骤最终配得500mL的溶液.①在配制过程中必需要用到的一种计量仪器是电子天平或分析天平.准确最取25.00mL待测液,用硝酸银标准液进行滴定,滴定前后滴定管中的液面读数如图2所示,则滴定过程中消耗标准液的体积为16mL.
②已知某温度时,一些银盐的颜色和Ksp如下表:
| 难溶盐 | AgCl | AgBr | AgI | Ag2CrO4 |
| Ksp | 2×10-10 | 5.4×10-13 | 8.3×10-17 | 2×10-12 |
| 颜色 | 白色 | 淡黄色 | 黄色 | 砖红色 |
a.CaCl2b.NaBr c.NaI d.K2CrO4
③滴定时,应将溶液调成中性,不能是强酸性或强碱性,其中不能是强碱性的原因是碱性条件下,硝酸银会生成氢氧化银或氧化银沉淀.
(4)已知制得的碱式碳酸镁可表示为xMgC03′yMg(OH)2H2O.若碱式碳酸镁的质量ag(不考虑微最杂质),充分灼烧后,测得剩余固体的质量为bg,产生的二氧他碳气体体积在标准状况下为cL,则碱式碳酸镁中x:y=40c:(22.4b-40c).(用b、c表示,不需化简)
15.铝与过氧化钠混合物粉末跟足量的水作用得到无色溶液,共生成气体1.75g,若得到的溶液恰好能使100mL 3.5mol/L的盐酸完全反应,且使产生的沉淀恰好溶解,则铝与过氧化钠的物质的量之比是( )
| A. | 1:2 | B. | 2:l | C. | 3:2 | D. | 2:3 |
2.设NA 为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,1.12 L CCl4含有C-Cl键的数目为0.2NA | |
| B. | 1 L 1 mol/L AlCl3溶液中含有NA个Al3+ | |
| C. | 常温常压下,4.4 g CO2与N2O的混合气体中含有的原子总数为0.3NA | |
| D. | 80 mL 10 mol•L-1盐酸与足量MnO2加热反应,产生的Cl2分子数为0.2NA |
19.下列说法正确的是( )
| A. | 所有的化学反应都有能量变化 | |
| B. | 需要加热的反应一定是吸热反应 | |
| C. | 所有的放热反应都可以在常温常压下自发进行 | |
| D. | 核能作为一种反应热,是理想的新能源 |
20.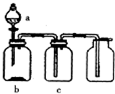 使用下表提供的试剂,利用如图所示的装置,能达到实验目的是( )
使用下表提供的试剂,利用如图所示的装置,能达到实验目的是( )
 使用下表提供的试剂,利用如图所示的装置,能达到实验目的是( )
使用下表提供的试剂,利用如图所示的装置,能达到实验目的是( )| 选项 | a中试剂 | b中试剂 | c中试剂 | 实验目的 |
| A | 稀盐酸 | 铁粉 | H2O | 制备并收集H2 |
| B | 稀硫酸 | Na2SO3粉末 | 浓硫酸 | 制备并收集干燥的SO2 |
| C | 浓盐酸 | KmnO4粉末 | NaOH溶液 | 制备并收集Cl2 |
| D | 浓氨水 | 生石灰 | 碱石灰 | 制备并收集干燥的NH3 |
| A. | A | B. | B | C. | C | D. | D |