题目内容
17.金属钠在氧气中充分燃烧生成产物是淡黄色,将所得产物投入水中,产物和水迅速发生反应,写出该反应的化学方程式:2Na2O2+2H2O=4NaOH+O2↑.分析 钠在氧气中燃烧生成过氧化钠,过氧化钠为淡黄色固体,过氧化钠与水反应生成氢氧化钠和氧气,据此解答.
解答 解:钠在氧气中燃烧生成过氧化钠,过氧化钠为淡黄色固体,过氧化钠与水反应生成氢氧化钠和氧气,化学方程式为:2Na2O2+2H2O=4NaOH+O2↑;
故答案为:淡黄;2Na2O2+2H2O=4NaOH+O2↑.
点评 本题考查了钠的性质,熟悉钠与氧气、过氧化钠与水的反应是解题关键,题目难度不大.

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案
相关题目
7.下列微粒中原子最外层电子数均为8的是( )
| A. | PCl5 | B. | NO2 | C. | NF3 | D. | H2O |
8.下列气体中,可用固体氢氧化钠干燥的是( )
| A. | Cl2 | B. | O2 | C. | SO2 | D. | NO2 |
5.下列离子方程式或化学方程中正确的是( )
| A. | 往NaHSO4溶液中滴加Ba(OH)2至溶液中性:SO42-+2H++Ba2++2OH-═BaSO4↓+2H2O | |
| B. | SO2通入酸性KMnO4溶液,褪色:2MnO4-+4H++5SO2═2Mn2++5SO42-+2H2O | |
| C. | 次氯酸钙溶液中通入过量二氧化碳:Ca2++2ClO-+H2O+CO2═CaCO3?+2HClO | |
| D. | 等物质的量MgCl2、Ba(OH)2和HCl溶液混合:Mg2++3OH-+H+═Mg(OH)2↓+H2O |
12.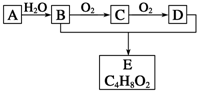 有机化合物A只由C、H两种元素组成且能使溴水褪色,其产量可以用来衡量一个国家石油化学工业的发展水平.A、B、C、D、E有如图所示的关系.则下列推断正确的是( )
有机化合物A只由C、H两种元素组成且能使溴水褪色,其产量可以用来衡量一个国家石油化学工业的发展水平.A、B、C、D、E有如图所示的关系.则下列推断正确的是( )
 有机化合物A只由C、H两种元素组成且能使溴水褪色,其产量可以用来衡量一个国家石油化学工业的发展水平.A、B、C、D、E有如图所示的关系.则下列推断正确的是( )
有机化合物A只由C、H两种元素组成且能使溴水褪色,其产量可以用来衡量一个国家石油化学工业的发展水平.A、B、C、D、E有如图所示的关系.则下列推断正确的是( )| A. | 鉴别A和甲烷可选择酸性高锰酸钾溶液 | |
| B. | B能与金属钠反应D不能 | |
| C. | 物质C和氢气反应生成乙醇,是还原反应 | |
| D. | E没有同分异构体 |
2.下列说法正确的是( )
| A. | 石墨与金刚石互为同系物 | B. | 32S与33S是同种核素 | ||
| C. | ${\;}_{2}^{4}$He原子核内含有4个质子 | D. | 二甲醚与乙醇 互为同分异构体 |
9.一定质量的Fe,Fe2O3,Fe3O4混合物与200mL 5mol•L-1盐酸恰好完反应,向反应后的溶液中加入KSCN溶液,液体不变红色,现在把相同质量的上述固体混合物在加热时与足量的氢气充分反应,可以得到固体铁的质量为( )
| A. | 28g | B. | 56g | C. | 14g | D. | 无法计算 |
6.下列分离混和物的实验计划中不正确的是( )
| A. | 分离乙酸(沸点118℃)与乙酸乙酯(沸点77.1℃)--蒸馏 | |
| B. | 从含有少量NaCl的KNO3溶液中提取KNO3--热水溶解、降温结晶、过滤 | |
| C. | 从水中分离出碘的CCl4溶液--用分液漏斗分液 | |
| D. | 将溴水中的溴转移到有机溶剂中--加入酒精萃取 |