题目内容
【题目】向NaBr、NaI、Na2SO3混合液中,通入过量氯气后,将溶液蒸干并充分灼烧,得到固体剩余物质的组成可能是 ( )
A.NaCl Na2SO4
B.NaCl NaBr Na2SO4
C.NaCl Na2SO4 I2
D.NaCl NaI Na2SO4
【答案】A
【解析】
混合溶液中有![]() ,由于
,由于![]() 都具有还原性,强弱顺序
都具有还原性,强弱顺序![]() ,当通入过量的氯气时,Cl2先把
,当通入过量的氯气时,Cl2先把![]() 氧化,再把
氧化,再把![]() 氧化变成I2,最后把
氧化变成I2,最后把![]() 氧化Br2,最后考虑碘单质和溴单质的物理性质。
氧化Br2,最后考虑碘单质和溴单质的物理性质。
通入Cl2后将按顺序发生以下三个反应:
①Na2SO3+Cl2+H2O=Na2SO4+2HCl
②2NaI+Cl2=2NaCl+I2,
③2NaBr+Cl2=2NaCl+Br2当Cl2过量时,蒸干灼烧,HCl、Br2会挥发,I2会升华,将得到Na2SO4和NaCl的混合物;
答案选A。

 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案【题目】工业上设计将VOSO4中的K2SO4、SiO2杂质除去并回收得到V2O5的流程如下:
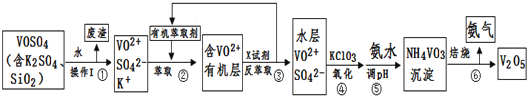
请回答下列问题:
(1)步骤①所得废渣的成分是____________写化学式),操作I的名称______。
(2)步骤②、③的变化过程可简化为(下式R表示VO2+,HA表示有机萃取剂):
R2(SO4)n(水层)+ 2nHA(有机层)![]() 2RAn(有机层) + nH2SO4 (水层)
2RAn(有机层) + nH2SO4 (水层)
②中萃取时必须加入适量碱,其原因是____________________________。
③中X试剂为___________________。
(3)⑤的离子方程式为________________________。
(4)25℃时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如下表:
pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
钒沉淀率% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
结合上表,在实际生产中,⑤中加入氨水,调节溶液的最佳pH为__________;
若钒沉淀率为93.1%时不产生Fe(OH)3沉淀,则溶液中c(Fe3+)<_____________。
(已知:25℃时,Ksp[Fe(OH)3]=2.6×10-39)
(5)该工艺流程中,可以循环利用的物质有______________和_______。