题目内容
8.如图所示,a、b两电极材料分别为铁丝和铜丝.则以下说法不正确的是( )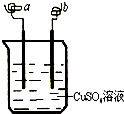
| A. | 该装置可以构成原电池,也可构成电解池 | |
| B. | a 极可能发生反应:Cu2++2e-→Cu | |
| C. | b 电极质量可能增加 | |
| D. | 该过程可能有大量气体产生 |
分析 该装置中如果有外接电源,就构成电解池;如果没有外接电源,就构成原电池.如果构成电解池时,连接电源负极的电极是阴极,阴极上得电子发生还原反应,连接电源正极的电极是阳极,阳极上失电子发生氧化反应;如果构成原电池,较活泼的金属铁作负极,负极上铁失电子发生氧化反应,较不活泼的金属铜作正极,正极上铜离子得电子发生还原反应.
解答 解:A、该装置中如果有外接电源,就构成电解池;如果没有外接电源,就构成原电池,故A正确;
B、如果该装置连接外接电源,且a连接电源负极,a就是电解池中的阴极,阴极上溶液中的铜离子得电子发生还原反应,电极反应式为Cu2++2e-═Cu,故B正确;
C、如果该装置为原电池时,较活泼的金属铁作负极,较不活泼的金属铜作正极,正极上铜离子得电子生成铜单质附着在电极上,电极反应式为Cu2++2e-═Cu,导致b极质量增加;如果该装置有外接电源,且b连接原电池负极,b为电解池的阴极,阴极上溶液中的铜离子得电子发生还原反应,电极反应式为Cu2++2e-═Cu,导致b极质量增加,故C正确;
D、该装置构成原电池时,负极上铁失电子,正极上铜离子得电子;构成电解池,阳极上铁或铜失电子,阴极上铜离子得电子,所以无论是原电池还是电解池都没有大量气体产生,故D错误.
故选D.
点评 本题考查了原电池和电解池原理,难度不大,注意铁和铜都是较活泼的金属,作电解池阳极时,金属材料失电子,不是溶液中的阴离子失电子.

练习册系列答案
相关题目
16.下列化学用语表示正确的是( )
| A. | 氯化氢的电子式: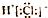 | |
| B. | 乙烷的结构简式:C2H6 | |
| C. | 铝的原子结构示意图: | |
| D. | 硫酸钠的电离方程式:Na2SO4=2Na++$S{{O}_{4}}^{2-}$ |
 A、B、C、D、E五中物质中都含有钠元素,其互相转化关系如题:
A、B、C、D、E五中物质中都含有钠元素,其互相转化关系如题: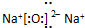 .
.
 +2H2O;
+2H2O; .
.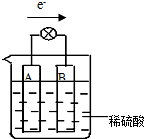 原电池是将化学能转变成电能的装置.某铜锌稀硫酸原电池中,电子由A极流出经导线流入B极,如图所示:
原电池是将化学能转变成电能的装置.某铜锌稀硫酸原电池中,电子由A极流出经导线流入B极,如图所示: 中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%.
中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%.