题目内容
17. 中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%.
中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%.(1)有效“减碳”的手段之一是节能,下列制氢方法最节能的是C
A.电解水制氢:2H2O电解_2H2↑+O2↑
B.高温使水分解制氢:2H2O高温_2H2↑+O2↑
C.太阳光催化分解水制氢:2H2OTiO2_太阳光2H2↑+O2↑
D.天然气制氢:CH4+H2O高温?CO+3H2
(2)CO2可转化成有机物实现碳循环.在体积为1L的密闭容器中,充入1molCO2和3mol H2,一定条件下反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1,测得CO2和CH3OH(g)的浓度随时间变化如图所示.
①从3min到9min,v(H2)=0.125mol•L-1•min-1
②能说明上述反应达到平衡状态的是D(填编号).
A.反应中CO2与CH3OH的物质的量浓度之比为1:1(即图中交叉点)
B.混合气体的密度不随时间的变化而变化
C.单位时间内消耗3mol H2,同时生成1mol HO
D.CO2的体积分数在混合气体中保持不变.
分析 (1)从充分利用太阳能的角度分析;
(2)①根据v=△c△t计算反应速率;
②化学反应达到平衡状态时正逆反应速率相等,各物质的浓度不变,由此衍生的物理量不变.
解答 解:(1)电解水、高温以及天然气的使用都会消耗能源,不符合低碳要求,使用太阳能可减小低碳,故答案为:C;
(2)①v(CO2)=△c△t=0.5mol/L−0.25mol/L9min−3min=0.417mol/L•min,则v(H2)=3v(CO2)=3×0.417mol/L•min=0.125mol/(L•min)-1,
故答案为:0.125;
②A.反应中CO2与CH3OH的物质的量浓度之比为1:1时,没有达到平衡状态,故A错误;
B.由于气体的总质量不变,容器的体积不变,则无论是否达到平衡状态,气体的密度都不变,故B错误;
C.化学反应速率之比等于化学计量数之比,无论是否达到平衡状态,都存在单位时间内每消耗3molH2,同时生成1molH2O,故C错误;
D.CO2的体积分数在混合气体中保持不变,说明达到平衡状态,故D正确.
故答案为:D.
点评 本题考查了化学平衡状态判断,反应速率的计算应用,掌握基础是关键,题目较简单.

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
8.如图所示,a、b两电极材料分别为铁丝和铜丝.则以下说法不正确的是( )
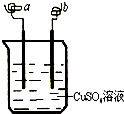

| A. | 该装置可以构成原电池,也可构成电解池 | |
| B. | a 极可能发生反应:Cu2++2e-→Cu | |
| C. | b 电极质量可能增加 | |
| D. | 该过程可能有大量气体产生 |
5.下列离子方程式中,正确的是( )
| A. | 一小块钾投入冷水中:K+2H2O═K++2OH-+H2↑ | |
| B. | 氯气通入碘化钠溶液中:2I-+Cl2═I2+2Cl- | |
| C. | 稀硫酸滴在铁片上:2Fe+6H+═2Fe3++3H2↑ | |
| D. | 氯气通入氯化亚铁溶液中:Fe2++Cl2═Fe3++2Cl- |
12.已知某混合金属粉末,除铝外还含有铁、铜中的一种或两种,所含金属的量都在5%以上.请设计合理实验探究该混合物金属粉末中铁、铜元素的存在.仅限选择的仪器和试剂:烧杯、试管、玻璃棒、量筒、容量瓶、滴管、药匙;1mol/L硫酸、2mol/L硝酸、2mol/LNaOH溶液、20%KSCN溶液.
完成以下实验探究过程:
(1)提出假设:
假设1 该混合金属粉末中除铝外还含有Fe(或Cu)元素;
假设2 该混合金属粉末中除铝外还含有Cu(或Fe)元素;
假设3 该混合金属粉末中除铝外还含有Fe、Cu元素;
(2)设计实验方案
基于假设3,设计出实验方案(不要在答题卡上作答).
(3)实验过程
根据(2)的实验方案,完成实验操作、预期现象和结论的有关问题.
完成以下实验探究过程:
(1)提出假设:
假设1 该混合金属粉末中除铝外还含有Fe(或Cu)元素;
假设2 该混合金属粉末中除铝外还含有Cu(或Fe)元素;
假设3 该混合金属粉末中除铝外还含有Fe、Cu元素;
(2)设计实验方案
基于假设3,设计出实验方案(不要在答题卡上作答).
(3)实验过程
根据(2)的实验方案,完成实验操作、预期现象和结论的有关问题.
| 编号 | 实验操作 | 预期现象 | 结论 |
| ① | 用药匙取少许样品,加入试管A中,再用滴管取过量NaOH溶液并滴加到试管A中,充分反应后,静置,弃去上层清液,剩余固体备用 | 样品部分溶解,并有气体放出 | |
| ② | 往试管A的剩余固体中加过量稀硫酸,充分反应后,静置.取上层清液于试管B中,剩余固体备用 | 固体部分溶解,并有气体放出,溶液呈浅绿色 | 可能含铁 (填元素名称,以下同) |
| ③ | 往试管B中加入少许稀硝酸,再滴加KSCN溶液 | 溶液先变黄色,加KSCN后显血红色 | 结合②可知,一定含 |
| ④ | 往②剩余固体中加入稀硝酸,再滴加NaOH溶液 | 固体溶解,有无色刺激性气体产生并很快变成红棕色,溶液显蓝色,加NaOH溶液后有蓝色 沉淀产生. | 一定含铜. |
9.2011年5月24日,台湾地区有关方面向国家质检总局通报,发现部分饮品中用于分散乳化油脂的食品添加剂“起云剂”中含有禁用物质“塑化剂”.起云剂常见原料是阿拉伯胶、乳化剂、棕榈油或葵花油,祸首台湾昱伸公司制造起云剂时偷梁换柱,用塑化剂取代成本贵5倍的棕榈油以图牟取暴利,与工业酒精勾兑、苏丹红、三聚氰胺事件类同,是极其恶劣的制假行为和严重的食品安全事件.塑化剂中最常见为邻苯二甲酸二(2-乙基己基)酯,简称DOP或DEHP,可用乙醛与邻苯二甲酸酸酐分步合成制得,路线如图.
(1)2CH3CHO→NaOH①CH3CH(OH)CH2CHO→−H2O②CH3CH=CHCHO③→CH3CH2CH2CHO
(2)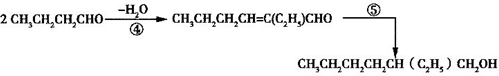
(3)利用邻苯二甲酸酸酐与2-乙基-1-乙醇合成DEHP
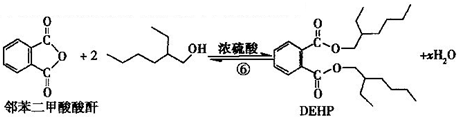
下列说法正确的是( )
(1)2CH3CHO→NaOH①CH3CH(OH)CH2CHO→−H2O②CH3CH=CHCHO③→CH3CH2CH2CHO
(2)
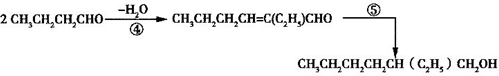
(3)利用邻苯二甲酸酸酐与2-乙基-1-乙醇合成DEHP

下列说法正确的是( )
| A. | 合成过程涉及加成、消去、酯化、聚合等类型的有机反应 | |
| B. | 步骤(1)中②反应发生的条件是在NaOH/醇溶液中加热,反应类型是消去反应 | |
| C. | 步骤(1)(2)连续操作时,③、⑤消耗H2物质的量相等 | |
| D. | ⑥反应方程式中产物H2O系数x=2,及时除去⑥中反应釜内的水可提高DEHP产率 |
17.在标准状况下,下列气体中的物质的量最大的是( )
| A. | CO2,100 mL | B. | O2,200 mL | C. | N2,400 mL | D. | CH4,600 mL |
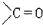 +RMgX→
+RMgX→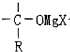
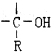

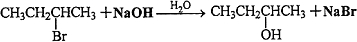 ,
, .
.