题目内容
18.元素X 位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2.元素Y基态原子的3p轨道上有2个未成对电子.元素Z 的原子最外层电子数是其内层的3倍.(1)X与Y所形成化合物晶体的晶胞如图所示.

①在1个晶胞中,X离子的数目为4.
②该化合物的化学式为ZnS.
(2)在Y的氢化物分子中,Y原子轨道的杂化类型是sp3.
(3)Z的氢化物在乙醇中的溶解度大于Y的氢化物,其原因是水分子与乙醇分子间能形成氢键.
(4)Y 与Z 可形成YZ42-
①YZ42-的空间构型为正四面体.
②写出一种与YZ42-互为等电子体的分子的化学式:CCl4或SiCl4.
(5)X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,1mol该配合物中含有σ键的数目为16NA.
分析 元素X 位于第四周期,其基态原子的内层轨道全部排满电子,则内层电子数=2+8+18=28,且最外层电子数为2,所以该原子有30个电子,为Zn元素;元素Y基态原子的3p轨道上有2个未成对电子,则Y是S或Si元素,结合题中与Zn形成的晶胞结构可知,在晶胞中X离子数为8×18+6×128×18+6×12=4,Y离子数为4,所以X、Y的个数比为1:1,可推得Y为S元素;元素Z的原子最外层电子数是其内层的3倍,元素最外层电子数小于或等于8,所以Z是O元素,据此答题.
解答 解:元素X 位于第四周期,其基态原子的内层轨道全部排满电子,则内层电子数=2+8+18=28,且最外层电子数为2,所以该原子有30个电子,为Zn元素;元素Y基态原子的3p轨道上有2个未成对电子,则Y是S或Si元素,结合题中与Zn形成的晶胞结构可知,在晶胞中X离子数为8×18+6×12=4,Y离子数为4,所以X、Y的个数比为1:1,可推得Y为S元素;元素Z的原子最外层电子数是其内层的3倍,元素最外层电子数小于或等于8,所以Z是O元素,
(1)根据上面的分析可知,①在1个晶胞中,X离子的数目为4,
②X为Zn,Y为S,X、Y的个数比为1:1,所以该化合物的化学式为ZnS,
故答案为:4;ZnS;
(2)H2S分子中,S原子的价层电子数=6+22=4,所以S原子的轨道的杂化类型是sp3杂化,
故答案为:sp3;
(3)在乙醇中的溶解度:H2O大于H2S,其主要原因是:水分子与乙醇分子间能形成氢键,
故答案为:水分子与乙醇分子间能形成氢键;
(4)①SO42-中S原子的价层电子数=4+12(6+2-4×2)=4,且没有孤电子对,所以是正四面体结构,
故答案为:正四面体;
②与SO42-互为等电子体的分子的化学式为CCl4或SiCl4,
故答案为:CCl4或SiCl4;
(5)Zn的氯化物与氨水反应可形成配合物[Zn(NH3)4]Cl2,一个化学式[Zn(NH3)4]Cl2中含有16个σ键,则1mol该配合物中含有σ键的数目16NA,
故答案为:16NA.
点评 本题考查物质结构和性质,涉及化学式确定、原子杂化方式判断、化学键的计算等知识点,熟练掌握基础知识并灵活运用基础知识解答问题是解本题关键,题目难度中等.

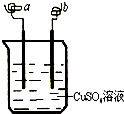
| A. | 该装置可以构成原电池,也可构成电解池 | |
| B. | a 极可能发生反应:Cu2++2e-→Cu | |
| C. | b 电极质量可能增加 | |
| D. | 该过程可能有大量气体产生 |
(1)2CH3CHO→NaOH①CH3CH(OH)CH2CHO→−H2O②CH3CH=CHCHO③→CH3CH2CH2CHO
(2)
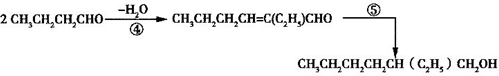
(3)利用邻苯二甲酸酸酐与2-乙基-1-乙醇合成DEHP
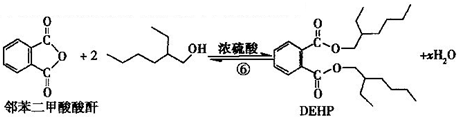
下列说法正确的是( )
| A. | 合成过程涉及加成、消去、酯化、聚合等类型的有机反应 | |
| B. | 步骤(1)中②反应发生的条件是在NaOH/醇溶液中加热,反应类型是消去反应 | |
| C. | 步骤(1)(2)连续操作时,③、⑤消耗H2物质的量相等 | |
| D. | ⑥反应方程式中产物H2O系数x=2,及时除去⑥中反应釜内的水可提高DEHP产率 |
| A. | 氟原子的结构示意图: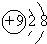 | B. | 乙烯结构式:CH2=CH2 | ||
| C. | 乙炔球棍模型: | D. | NH3的电子式: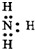 |
①取5只大小相同的集气瓶,标为1,2,3,4,5,分别倒扣在水槽中并使瓶内留有10%,20%,30%,40%,50%体积的水,并用毛玻璃盖住.
②向大试管中加入1:10(质量比)的二氧化锰和氯酸钾的混合物,加热使其反应,分别用排水集气法将上述1~5号瓶中水排去,再用玻璃片盖住集气瓶口取出放置好.
③分别将带有余烬的木条伸入1~5号瓶中,观察并记录现象如下:
| 编号 | 1 | 2 | 3 | 4 | 5 |
| 现象 | 微亮 | 亮 | 很亮 | 复燃 | 复燃 |
(1)用排水法集气收得氧气后,3号瓶中氧气的体积分数约为44.7%.
(2)如果要得到更精确的数据,下一步实验研究应如何做?
| A. | CO2,100 mL | B. | O2,200 mL | C. | N2,400 mL | D. | CH4,600 mL |
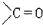 +RMgX→
+RMgX→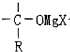
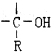

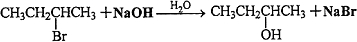 ,
, .
.
 .
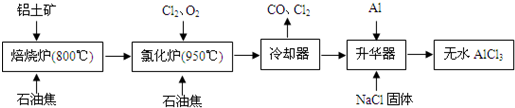
.
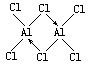 .
.