题目内容
 已知:N2O4(g)?2NO2(g)△H=+57.20kJ?mol-1.
已知:N2O4(g)?2NO2(g)△H=+57.20kJ?mol-1.在10℃时,将0.100mol N2O4气体充入lL恒容抽空的密闭容器中,每隔一定时间对该容器内的物质浓度进行分析得到如表数据:
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| c(N2O4)/mol/L | 0.100 | c1 | 0.050 | c3 | c4 |
| c(NO2)/mol/L | 0.000 | 0.060 | c2 | 0.120 | 0.120 |
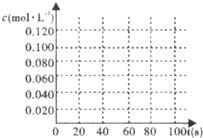
(2)在图中画出并标明此反应中N2O4和NO2的浓度随时间变化的曲线.
(3)在上述条件下,从反应开始至达到化学平衡时,四氧化二氮的平均反应速率为
(4)若起始时充入N02气体0.200mol,则达到平衡时N02气体的转化率为
A.减小NO2的浓度 B.降低温度 C.增加NO2的浓度 D.升高温度E.再充入一定量的He
(5)向容积相同、温度分别为T1和T1的两个密闭容器中分别充入等量N02,发生反应:
2NO2(g)?N2O4(g)△H=-57.20kJ?mol-1.
恒温恒容下反应相同时间后,分别测得体系中N02的百分含量分别为a1和a2;巳知T1<T22,则a1
A.大于 B.小于 C.等于 D.以上都有可能.
考点:物质的量或浓度随时间的变化曲线,化学平衡建立的过程,化学平衡的影响因素
专题:化学平衡专题
分析:(1)平衡常数等于生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积,根据方程式计算c2、c1,据此解答;60s后反应达平衡,反应混合物各组分的浓度不变;
(2)依据起始浓度,平衡浓度和图表中的浓度,描点画出变化图象;
(3)由表可知,60s时反应达平衡,根据方程式计算△c(N2O4),依据化学反应速率V=
计算得到;
(4)依据平衡浓度计算平衡常数,结合化学平衡三段式列式计算,转化率=
×100%,依据化学平衡原理分析改变条件提高NO2转化率的选项;
(5)升高温度平衡向逆反应进行,平衡时二氧化氮的含量增大,温度越高反应速率越快,到达平衡的时间越短,据此作出二氧化氮含量与时间关系草图,据此判断.
(2)依据起始浓度,平衡浓度和图表中的浓度,描点画出变化图象;
(3)由表可知,60s时反应达平衡,根据方程式计算△c(N2O4),依据化学反应速率V=
| △c |
| △t |
(4)依据平衡浓度计算平衡常数,结合化学平衡三段式列式计算,转化率=
| 消耗量 |
| 起始量 |
(5)升高温度平衡向逆反应进行,平衡时二氧化氮的含量增大,温度越高反应速率越快,到达平衡的时间越短,据此作出二氧化氮含量与时间关系草图,据此判断.
解答:
解:(1)N2O4(g)?2NO2(g),反应的平衡常数K=
;
20s时c(NO2)=0.060mol/L
N2O4?2 NO2,
浓度变化 0.030mol 0.060mol/L
c1=0.10mol/L-0.03mol/L=0.070mol/L;
由表可知,40s时,c(N2O4)=0.050mol/L,
N2O4?2 NO2,
浓度变化:(0.1-0.05)mol/L 0.10mol/L
所以c2=0.10mol/L
所以c2>c1;
故答案为:
;<;=;
(2)依据图表中物质的浓度在坐标系中描点画出变化图象,平衡状态(NO2)=0.120mol/L,c(N2O4)=0.10mol/L-0.060mol/L=0.04mol/L,得到的图象为:
 ,答:
,答: ;
;
(3)由表可知,60s时反应达平衡,c(NO2)=0.120mol/L,
N2O4?2 NO2,
浓度变化:0.06mol/L 0.120mol/L
V(N2O4)=
=0.001mol/(L?s);
故答案为:0.001mol/(L?s);
(4)依据平衡浓度计算平衡常数,结合化学平衡三段式列式计算;
N2O4?2 NO2,
起始量(mol/L) 0.10 0
变化量(mol/L) 0.06 0.12
平衡量(mol/L) 0.04 0.12
K=
=0.36
若起始时充入N02气体0.200mol,设消耗二氧化氮物质的量浓度为x,2 NO2=N2O4 ,K=
2 NO2=N2O4
起始量(mol/L) 0.200 0
变化量(mol/L) x 0.5x
平衡量(mol/L) 0.200-x 0.5x
K=
=
x=0.08mol/L
则达到平衡时N02气体的转化率=
×100%=40%
2 NO2=N2O4 反应是气体体积减小的放热反应,依据化学平衡原理分析选项,增大二氧化氮转化率的条件;
A.减小NO2的浓度,平衡逆向进行,二氧化氮转化率减小,故A不符合;
B.降低温度,平衡正向进行,二氧化氮转化率增大,故B符合;
C.增加NO2的浓度,恒容容器中相当于增大压强,平衡正向进行,二氧化氮转化率增大,故C符合;
D.升高温度,平衡逆向进行,二氧化氮转化率减小,故D不符合;
E.再充入一定量的He,总爱增大,气体分压不变,平衡不变,二氧化氮转化率不变,故E不符合;
故答案为:40%;BC;
(5)升高温度平衡向逆反应进行,平衡时二氧化氮的含量增大,温度越高反应速率越快,到达平衡的时间越短,据此作出二氧化氮含量与时间关系草图为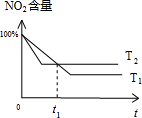 ,由图可知,t1时刻a1=a2,t1时刻之前a1>a2,t1时刻之后a1<a2,故答案为:D.
,由图可知,t1时刻a1=a2,t1时刻之前a1>a2,t1时刻之后a1<a2,故答案为:D.
| c2(NO2) |
| c(N2O4) |
20s时c(NO2)=0.060mol/L
N2O4?2 NO2,
浓度变化 0.030mol 0.060mol/L
c1=0.10mol/L-0.03mol/L=0.070mol/L;
由表可知,40s时,c(N2O4)=0.050mol/L,
N2O4?2 NO2,
浓度变化:(0.1-0.05)mol/L 0.10mol/L
所以c2=0.10mol/L
所以c2>c1;
故答案为:
| c2(NO2) |
| c(N2O4) |
(2)依据图表中物质的浓度在坐标系中描点画出变化图象,平衡状态(NO2)=0.120mol/L,c(N2O4)=0.10mol/L-0.060mol/L=0.04mol/L,得到的图象为:
 ,答:
,答: ;
;(3)由表可知,60s时反应达平衡,c(NO2)=0.120mol/L,
N2O4?2 NO2,
浓度变化:0.06mol/L 0.120mol/L
V(N2O4)=
| 0.060mol/L |
| 60s |
故答案为:0.001mol/(L?s);
(4)依据平衡浓度计算平衡常数,结合化学平衡三段式列式计算;
N2O4?2 NO2,
起始量(mol/L) 0.10 0
变化量(mol/L) 0.06 0.12
平衡量(mol/L) 0.04 0.12
K=
| 0.122 |
| 0.04 |
若起始时充入N02气体0.200mol,设消耗二氧化氮物质的量浓度为x,2 NO2=N2O4 ,K=
| 1 |
| 0.36 |
2 NO2=N2O4
起始量(mol/L) 0.200 0
变化量(mol/L) x 0.5x
平衡量(mol/L) 0.200-x 0.5x
K=
| .5x |
| (0.200-x)2 |
| 1 |
| 0.36 |
x=0.08mol/L
则达到平衡时N02气体的转化率=
| 0.08mol/L |
| 0.20mol/L |
2 NO2=N2O4 反应是气体体积减小的放热反应,依据化学平衡原理分析选项,增大二氧化氮转化率的条件;
A.减小NO2的浓度,平衡逆向进行,二氧化氮转化率减小,故A不符合;
B.降低温度,平衡正向进行,二氧化氮转化率增大,故B符合;
C.增加NO2的浓度,恒容容器中相当于增大压强,平衡正向进行,二氧化氮转化率增大,故C符合;
D.升高温度,平衡逆向进行,二氧化氮转化率减小,故D不符合;
E.再充入一定量的He,总爱增大,气体分压不变,平衡不变,二氧化氮转化率不变,故E不符合;
故答案为:40%;BC;
(5)升高温度平衡向逆反应进行,平衡时二氧化氮的含量增大,温度越高反应速率越快,到达平衡的时间越短,据此作出二氧化氮含量与时间关系草图为
 ,由图可知,t1时刻a1=a2,t1时刻之前a1>a2,t1时刻之后a1<a2,故答案为:D.
,由图可知,t1时刻a1=a2,t1时刻之前a1>a2,t1时刻之后a1<a2,故答案为:D.
点评:本题考查化学平衡的有关计算、化学平衡的影响因素与平衡图象分析,题目综合性较大,注意基础知识的积累掌握.

练习册系列答案
相关题目
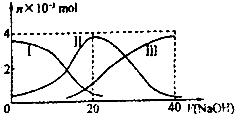 常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量 变化如图(其中I代表H2A,Ⅱ代表HA-,Ⅲ代表A2-).根据图示判断,下列说法正确的是( )
常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量 变化如图(其中I代表H2A,Ⅱ代表HA-,Ⅲ代表A2-).根据图示判断,下列说法正确的是( )| A、当V(NaOH)=20mL时,溶液中离子浓度大小关系 c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) |
| B、等体积等浓度的NaOH溶液与H2A溶液混合后其溶液中水的电离程度比纯水大 |
| C、欲使NaHA溶液呈中性,可以向其中加入酸或碱 |
| D、向NaHA溶液加人水的过程中,pH可能增大也可能减小 |
X元素的阳离子和Y元素的阴离子具有相同的核外电子层结构.下列叙述中正确的是( )
| A、原子序数:X<Y |
| B、原子半径:X<Y |
| C、原子半径:X>Y |
| D、原子最外层电子数:X<Y |
草酸是二元中强酸,草酸氢钠溶液显酸性.常温下,向10mL 0.01mol?L-1 NaHC2O4溶液中滴加0.01mol?L-1 NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是( )
| A、V(NaOH)=0时,c(H+)=1×10-2mol?L-1 |
| B、V(NaOH)<10mL时,可能存在c(Na+)=2c(C2O42-)+c(HC2O4-) |
| C、V(NaOH)=10mL时,c(H+)=1×10-7mol/L |
| D、V(NaOH)>10mL时,一定有c(Na+)>c(C2O42-)>c(OH-)>c(HC2O4-) |
为减少汽车尾气对大气造成的污染,目前市场上推出了使用乙醇汽油(在汽油中加入适量乙醇)的汽车.下列叙述错误的是( )
| A、乙醇汽油是一种化合物 |
| B、汽车使用乙醇汽油可以减少有害气体的排放 |
| C、乙醇充分燃烧生成CO2和H2O |
| D、用粮食发酵可制得乙醇 |
NA代表阿伏伽德罗常数的值,下列说法正确的是( )
| A、5.6g铁在足量氯气中燃烧,电子转移0.3NA个 |
| B、标准状况下,2.24L水中含有0.1NA个水分子 |
| C、1.12L氯气中反应0.1NA个氯原子 |
| D、12g石墨和C60的混合固体中,含碳原子NA个 |