题目内容
7.NA代表阿伏伽德罗常数,下列说法不正确的是( )| A. | 10gD2O中含有的电子数为5NA | |
| B. | 1molC3H8分子中共价键总数为10NA | |
| C. | 92gNO2和N2O4混合气体中含有原子数为3NA | |
| D. | 65gZn全部溶解在一定浓度的硝酸溶液中,有NO生成,则转移的电子数为2NA |
分析 A.D2O中含有10个电子,重水的摩尔质量为20g/mol,据此进行计算10g重水含有的电子数;
B.丙烷分子中含有2个碳碳键和8个碳氢键,总共含有10个共价键;
C.NO2和N2O4最简式同为NO2,根据最简式计算92gNO2中所含原子数;
D.锌为2价金属,65g锌的物质的量为1mol,完全反应转移2mol电子.
解答 解:A.10g重水(D2O)的物质的量是:$\frac{10g}{20g/mol}$=0.5mol,D2O分子中含有10个电子,则0.5mol重水中含有的电子数为5NA,故A正确;
B.1molC3H8分子中含有2mol碳碳键、8mol碳氢键,总共含有10mol共价键,含有的共价键总数为10NA,故B正确;
C.92gNO2和N2O4的混合物中含有最简式NO2的物质的量为:$\frac{92g}{46g/mol}$=2mol,则混合物中含有的原子数=2×3×NA=6NA,故C错误;
D.65gZn的物质的量为1mol,1mol锌全部溶解在一定浓度的硝酸溶液中,最多失去2mol电子,则转移的电子数为2NA,故D正确;
故选C.
点评 本题考查了阿伏伽德罗常数的综合应用,题目难度中等,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系为解答关键,C为易错点,注意明确最简式在化学计算中的应用.

练习册系列答案
 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案
相关题目
3.指定条件下,下列说法中正确的是( )
| A. | 常温下,28g C2H4中含有的极性共价键数为6NA | |
| B. | 在氢氧化钡溶液中加入少量的硫酸氢钠溶液:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| C. | 浓度均为0.1 mol•L-1的C6H5ONa溶液和CH3COONa溶液中:阴离子的总浓度前者小于后者 | |
| D. | 常温下,浓度分别为0.1 mol•L-1和0.01 mol•L-1的CH3COOH溶液中:CH3COO-离子浓度前者是后者的10倍 |
4.16mL由NO与NH3组成的混合气体在催化剂作用下于400℃左右可发生反应:6NO+4NH3?5N2+6H2O(g),达到平衡时在相同条件下气体体积变为17.5mL,则原混合气体中NO与NH3的物质的量之比有四种情况:①5:3;②3:2;③4:3;④9:7.其中正确的是( )
| A. | ①② | B. | ①④ | C. | ②③ | D. | ③④ |
15.设nA代表阿伏加德罗常数(nA)的数值,下列说法正确的是( )
| A. | 标准状况下,22.4 L HCl溶于水后溶液中含有nA个HCl分子 | |
| B. | 1L 0.1 mol•L-1的Na2SO4溶液中含有0.2 nA个Na+ | |
| C. | 1 mol 硫酸钾中阴离子所带电荷数为nA | |
| D. | 将0.1mol氯化铁溶于1L水中,所得溶液含有0.1nAFe3+ |
2.盛有O2和NO2的混合气体的量筒倒立在盛有水的水槽中,过一段时间后,量筒内的气体体积减小为原来的一半.则原混合气体中O2和NO2的体积比是( )
| A. | 3:1 | B. | 3:2 | C. | 2:1 | D. | 1:2 |
19.在恒容密闭容器中发生反应2SO2+O2?2SO3,当其他条件不变时,只改变一个条件,不能加快化学反应速率的是( )
| A. | 增加SO2的浓度 | B. | 充入一定量惰性气体 | ||
| C. | 升高温度 | D. | 使用催化剂 |
16.烷烃C5H12的同分异构体数目是( )
| A. | 2 | B. | 3 | C. | 4 | D. | 5 |
17.如图是恒温下某反应的化学反应速率随反应时间变化的示意图.下列叙述与示意图不相符合的是( )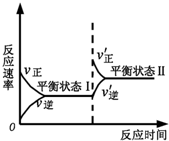

| A. | 反应达平衡时,正反应速率和逆反应速率相等 | |
| B. | 该反应达到平衡状态Ⅰ后,减小反应物浓度,平衡发生移动,达到平衡状态Ⅱ | |
| C. | 该反应达到平衡状态Ⅰ后,增大反应物浓度,平衡发生移动,达到平衡状态Ⅱ | |
| D. | 同一种反应物在平衡状态Ⅰ和平衡状态Ⅱ时浓度不相等 |
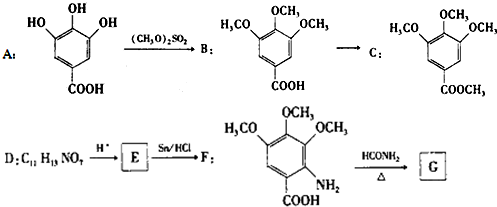
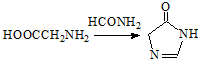
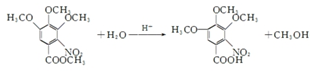 .
.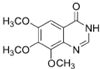 .
.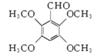 .
.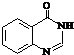 .合成过程中无机试剂任选.
.合成过程中无机试剂任选.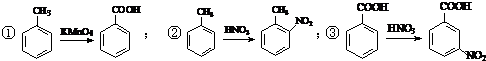 )
)