题目内容
4.16mL由NO与NH3组成的混合气体在催化剂作用下于400℃左右可发生反应:6NO+4NH3?5N2+6H2O(g),达到平衡时在相同条件下气体体积变为17.5mL,则原混合气体中NO与NH3的物质的量之比有四种情况:①5:3;②3:2;③4:3;④9:7.其中正确的是( )| A. | ①② | B. | ①④ | C. | ②③ | D. | ③④ |
分析 依据反应前后气体体积变化量及差量法计算消耗NO和氨气的体积,气体体积之比等于物质的量之比,利用讨论法分析计算原混合气体组成即可.
解答 解:6NO+4NH3?5N2+6H2O△v增大
6 4 5 6 1
9mL 6mL 7.5mL 9mL (17.5-16)mL=1.5mL
反应后NO和NH3的混合气体中剩余的气体:16mL-9mL-6mL=1mL,
若剩余NO,则原混合气体中NO体积为:9mL+1mL=10mL,NH3的体积6mL,在原混合气体中NO和NH3的物质的量之比为:10mL:6mL=5:3;
若剩余NH3则原混合气体中NH3的体积为:6mL+1mL=7mL,NO为9mL,在原混合气体中NO和NH3的物质的量之比为:9mL:7mL=9:7;
此反应为逆反应 不可能进行完全 所以比值应处于①④之间,
故选C.
点评 本题考查混合物反应的计算,题目难度中等,注意掌握差量法、讨论法在化学计算中的应用,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
14.下列实验现象中,由于发生取代反应而引起的是( )
| A. | 乙烯通入溴的四氯化碳溶液中,溶液褪色 | |
| B. | 苯滴加到溴水中,振荡后水层接近无色 | |
| C. | 将灼热的铜丝迅速插入乙醇中,反复多次,有刺激性气味产生 | |
| D. | 甲烷和氯气的混合气体在光照后,瓶壁上有油状液滴附着 |
15.下列装置或操作能达到实验目的是( )
| A. | 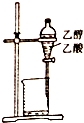 除去乙醇中的乙酸 | B. | 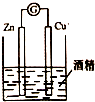 形成原电池 | ||
| C. | 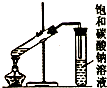 制取乙酸乙酯 | D. | 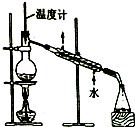 石油的蒸馏 |
19.下列关于化学键的说法正确的是( )
| A. | 构成单质分子的微粒一定含有共价键 | |
| B. | 全部由非金属元素形成的化合物不一定只含共价键 | |
| C. | 离子化合物中不可能含有非极性键 | |
| D. | 非极性键只存在于双原子单质分子中 |
10.下列溶液一定显酸性的是( )
| A. | [H+]=[OH-]的溶液 | B. | pH<7的溶液 | ||
| C. | [H+]=1.0×10-7mol•L-1 的溶液 | D. | [H+]>[OH-]的溶液 |
7.NA代表阿伏伽德罗常数,下列说法不正确的是( )
| A. | 10gD2O中含有的电子数为5NA | |
| B. | 1molC3H8分子中共价键总数为10NA | |
| C. | 92gNO2和N2O4混合气体中含有原子数为3NA | |
| D. | 65gZn全部溶解在一定浓度的硝酸溶液中,有NO生成,则转移的电子数为2NA |
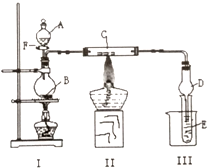 用如图所示装置进行有关实验,拔掉分液漏斗上口玻璃塞,打开F,将A逐滴加入至B中.
用如图所示装置进行有关实验,拔掉分液漏斗上口玻璃塞,打开F,将A逐滴加入至B中.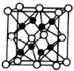 X、Y、Z、R、W均为周期表中前四周期的元素,其原子序数依次增大,其中只有W为第四周期元素.X与Y基态原子的成对电子数之比为2:3,未成对电子数之比为1:1,Z是元素周期表中s区元素,但有未成对电子,R的氢化物的沸点比其上周期同族元素氢化物的沸点低,W为金属元素,Y与W形成的某种化合物与R的氢化物的浓溶液加热时反应可用于实验室制取R的气态单质,回答下列问题:
X、Y、Z、R、W均为周期表中前四周期的元素,其原子序数依次增大,其中只有W为第四周期元素.X与Y基态原子的成对电子数之比为2:3,未成对电子数之比为1:1,Z是元素周期表中s区元素,但有未成对电子,R的氢化物的沸点比其上周期同族元素氢化物的沸点低,W为金属元素,Y与W形成的某种化合物与R的氢化物的浓溶液加热时反应可用于实验室制取R的气态单质,回答下列问题:
 .
. .
.