题目内容
14.某一化学课外活动小组进行探究实验,其实验装置如图所示: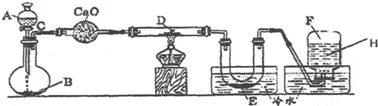
A~F属于下列物质中的六种:浓氨水、稀氨水、稀硫酸、水、氢氧化钠、氧化铁、氧化铜、氨气、氮气、氧气.
实验现象:
①D物质由黑色变为红色
②点燃的镁条伸入无色无味的气体F中,镁条表面生成一种灰黄色固体物质.将该灰
黄色物质放入水中,有气体放出,并有白色浑浊形成.该气体成分就是C,具有刺激性气
味,并能使润湿的红色石蕊试纸变蓝.通过分析回答:
(1)连接好实验装置后.开始检查整套装置气密性:首先将导管放入 (填“放入”或“不放入”,下同)水槽中,U形管不放入装有冷水的水槽中,后续操作为关闭分液漏斗活塞,微热烧瓶,直至观察到特定的现象,证明装置气密性良好.
(2)装CaO的仪器名称是干燥管.写出下列标号的物质名称:
A浓氨水,B氢氧化钠,D氧化铜.
(3)写出有关反应的化学方程式:
烧瓶中的反应NH3•H2O$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O;
硬质玻璃管中的反应2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2+3H2O;
F与Mg的反应产物与水的反应Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑.
(4)该小组同学预测的现象是,少量无水硫酸铜粉末放入无色透明的E中得到蓝色溶液,实际上能看到蓝色沉淀,由此可推论:预测的E是水 (选填所列物质名称,下同),E真正的成分是稀氨水.想要利用上述装置收集到较纯净的气体F,则H最好选稀硫酸.
分析 ①D物质由黑色变为红色,说明是CuO被还原生成了Cu;
②点燃的镁条伸入无色无味的气体F中,镁条表面生成一种灰黄色固体物质.将该灰黄色物质放入水中,有气体放出,并有白色浑浊形成.该气体成分就是C,具有刺激性气味,并能使润湿的红色石蕊试纸变蓝说明生成的气体是NH3,证明黄色固体和水反应生成白色沉淀为Mg(OH)2和氨气,推断灰黄色固体物质为Mg3N2,F中收集到的气体为N2,则推断和D处CuO反应的为NH3,所以A中为浓氨水,B中可以是固体氢氧化钠,反应生成氨气通过干燥管中的氧化钙干燥,得到干燥的氨气,通过加热的玻璃管和CuO反应生成Cu、N2和水,E装置冷却得到液态水,最后在H处排水法收集到气体F为N2,
(1)连接好实验装置后.开始检查整套装置气密性,需要密闭整套装置,把导气管通入水槽中,U形管移出冷水,微热烧瓶,观察水槽中是否有气泡冒出,冷却后是否有一段水柱上升判断;
(2)装CaO的仪器名称是干燥管,上述分析可知AB为制备氨气的试剂,选择浓氨水和固体氢氧化钠,D为氧化铜;
(3)A与B是浓氨水滴入固体氢氧化钠,溶解放热,一水合氨分解生成氨气的反应,C与D是氨气 和氧化铜发生氧化还原反应生成氮气、铜和水,F与Mg的反应生成Mg3N2,Mg3N2与水反应生成氢氧化镁白色沉淀和氨气;
(4)少量无水硫酸铜粉末放入无色透明的E中得到蓝色溶液,说明E处是水,实际上能看到蓝色沉淀说明E为氨水,为除去混有的氨气,可以在H处用排稀硫酸的方法收集氮气.
解答 解:(1)连接好实验装置后.开始检查整套装置气密性,需要密闭整套装置,关闭分液漏斗活塞,把最后的导气管通入水槽中,U形管移出冷水,微热烧瓶,观察水槽中有气泡冒出,冷却后是导气管中有一段水柱上升,说明装置气密性完好,
故答案为:放,不放,氢氧化钠,氧化铜;
(2)依据装置图分析,装CaO的仪器名称是干燥管,上述分析可知AB为制备氨气的试剂,选择浓氨水和固体氢氧化钠,固体氢氧化钠溶解后放热使一水合氨分解生成氨气,D为氧化铜,
故答案为:干燥管,浓氨水,氢氧化钠,氧化铜;
(3)A与B是浓氨水滴入固体氢氧化钠,溶解放热,一水合氨分解生成氨气的反应,的化学方程式为:NH3•H2O$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O,
C与D是氨气 和氧化铜发生氧化还原反应生成氮气、铜和水,反应的化学方程式为:2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2+3H2O,
F与Mg的反应生成Mg3N2,Mg3N2与水反应生成氢氧化镁白色沉淀和氨气,反应的化学方程式为:Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑,
故答案为:NH3•H2O$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O,2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2+3H2O,Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑;
(4)少量无水硫酸铜粉末放入无色透明的E中得到蓝色溶液,说明E处是水,硫酸铜溶于水形成硫酸铜蓝色溶液,实际上能看到蓝色沉淀,说明E处氨气和水被冷却得到成分为氨水,加入硫酸铜会反应生成氢氧化铜蓝色沉淀,为除去混有的氨气,可以在H处用排稀硫酸的方法收集氮气,
故答案为:水,稀氨水,稀硫酸.
点评 本题考查了物质制备,物质性质的分析应用,主要是氨气的还原性,生成产物的性质分析,掌握反应现象和实验基本操作是解题关键,题目难度中等.

| A. | 在同温同压下,相同体积的任何气体所含的原子数相同 | |
| B. | 相同条件下,N2和O2的混合气体与等体积的N2所含原子数相等 | |
| C. | 等物质的量的NH4+和OH-所含质子数相等且电子数也相等 | |
| D. | 1mol 乙基中含有的电子数为18NA |
| A. | 由同种元素组成的物质一定属于纯净物 | |
| B. | NaHCO3在水中电离:NaHCO3═Na++H++CO32- | |
| C. | 含金属元素的离子不一定都是阳离子 | |
| D. | 具有相同质子数的微粒都属于同种元素 |
| A. | 静电除尘 | |
| B. | 一支钢笔用不同牌子的两种墨水,易堵塞 | |
| C. | 氯化铁溶液加入碳酸钠溶液出现红褐色沉淀 | |
| D. | 河水和海水交界处形成三角洲 |
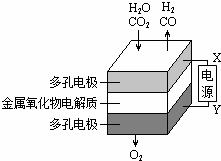 在固态金属氧化物电解池中,高温共电解H2O~CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示.下列说法不正确的是( )
在固态金属氧化物电解池中,高温共电解H2O~CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示.下列说法不正确的是( )| A. | X是电源的负极 | |
| B. | 阴极的反应式是:H2O+2eˉ=H2+O2ˉ | |
| C. | 总反应可表示为:H2O+CO2=H2+CO+O2 | |
| D. | 阴、阳两极生成的气体的物质的量之比是2:1 |
| 选项 | 实 验 操 作 及 现 象 | 实 验 结 论 |
| A | 向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成 | 该溶液中一定含有SO${\;}_{4}^{2-}$ |
| B | 向某溶液中加入盐酸,能产生使澄清石灰水变浑浊的气体 | 该溶液中一定含CO32- |
| C | 向某溶液中加入适量NaOH稀溶液,将湿润的红色石蕊试纸放在试管口,试纸不变色 | 该溶液中一定不含NH4+ |
| D | 用干燥洁净的铂丝蘸取某溶液放在酒精灯火焰上灼烧,透过蓝色钴玻璃观察到火焰呈紫色 | 该溶液一定含有钾元素,可能含有钠元素 |
| A. | A | B. | B | C. | C | D. | D |
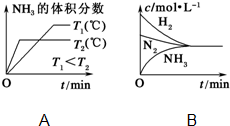 已知工业上合成氨反应N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol,回答以下问题:
已知工业上合成氨反应N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol,回答以下问题: