题目内容
3. 已知工业上合成氨反应N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol,回答以下问题:
已知工业上合成氨反应N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol,回答以下问题:(1)该反应的化学平衡常数表达式为K=$\frac{[N{H}_{3}]^{2}}{[{N}_{2}]•[{H}_{2}]^{3}}$,温度越高,其平衡常数的值越减小.(填“增大”“减小”“不变”)
(2)某温度下,若把1mol N2与3mol H2置于体积为1L的密闭容器内,反应达到平衡状态时,测得混合气体中氨的物质的量为2/3mol,则该温度下反应的K=$\frac{1}{12}$(可用分数表示).能说明该反应达到化学平衡状态的是bd(填字母).
a.容器内的密度保持不变 b.容器内压强保持不变
c.v正(N2)=2v逆(NH3) d.混合气体中c(NH3)不变
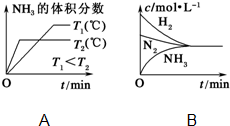
(3)对于合成氨反应而言,下列有关图象一定正确的是(选填序号)A
(4)相同温度下,有恒容密闭容器A和恒压密闭容器B,两容器中均充入1mol N2和3mol H2,此时两容器的体积相等.在一定条件下反应达到平衡状态,A中NH3的体积分数为a,放出热量Q1kJ;B中NH3的体积分数为b,放出热量Q2kJ.则:a<b(填“>”、“=”或“<”,下同),Q1<Q2,Q1<92.4.
分析 (1)化学平衡常数K=$\frac{生成物浓度系数的幂次方}{反应物浓度系数的幂次方}$,该反应放热,升温平衡逆向移动;
(2)N2(g)+3H2(g)?2NH3(g)
开始 1 3 0
转化 x 3x 2x
平衡1-$\frac{1}{3}$ 3-1 $\frac{2}{3}$
根据K=$\frac{[N{H}_{3}]^{2}}{[{N}_{2}]•[{H}_{2}]^{3}}$,进行计算;化学反应达到平衡状态时,正逆反应速率相等,各组分浓度保持不变,据此分析;
(3)A.先出现拐点的先达到平衡,则T2大,温度高,平衡逆向移动;
B.平衡时浓度不一定相等;
(4)恒容密闭容器A,反应达到平衡状态,A中NH3的体积分数为a,放出热量Q1kJ,
而恒压密闭容器B,均充入1mol N2和3molH2,反应发生后总物质的量减少,由pV=nRT可知,相对于A来说,相当于B加压,则平衡正向移动.
解答 解:(1)化学平衡常数K=$\frac{生成物浓度系数的幂次方}{反应物浓度系数的幂次方}$=$\frac{[N{H}_{3}]^{2}}{[{N}_{2}]•[{H}_{2}]^{3}}$,该反应放热,升温平衡逆向移动,化学平衡常数减小,故答案为:$\frac{[N{H}_{3}]^{2}}{[{N}_{2}]•[{H}_{2}]^{3}}$;减小;
(2)K=$\frac{[N{H}_{3}]^{2}}{[{N}_{2}]•[{H}_{2}]^{3}}$=$\frac{{(\frac{2}{3})}^{2}}{\frac{2}{3}×{2}^{3}}$=$\frac{1}{12}$,
a.容器体积不变,气体质量不变,所以容器内的密度始终保持不变,故a不选;
b.容器体积不变,反应前后气体物质的量不同,所以容器内压强保持不变说明反应达到平衡状态,故b选;
c.v正(N2)=2v逆(NH3),不符合化学计量数之比,故c不选;
d.混合气体中c(NH3)不变,说明各组分浓度都不变,反应达到平衡状态,故d选;
故答案为:$\frac{1}{12}$;bd;
(3)A.先出现拐点的先达到平衡,则T2大,温度高,平衡逆向移动,与图象一致,故A正确;
B.平衡时浓度不一定相等,平衡浓度取决起始浓度和转化率,图象表示错误,故B错误;
故答案为:A;
(4)恒容密闭容器A,反应达到平衡状态,A中NH3的体积分数为a,放出热量Q1kJ,
而恒压密闭容器B,均充入1mol N2和3molH2,反应发生后总物质的量减少,由pV=nRT可知,相对于A来说,相当于B加压,则平衡正向移动,氨气的体积分数变大,所以a<b,B中放出的热量对,则Q1<Q2,热化学方程式中反应热为完全反应放出的热量,而A中不能完全转化,放出的热量少,则Q1<92.4,
故答案为:<;<;<.
点评 本题考查较综合,涉及化学平衡的计算、影响反应速率及平衡的因素、平衡的判定、热化学反应方程式,化学平衡图象等,注重高考常考查点的考查,注意图象的分析,题目难度中等.

| A. | 溶质物质的量浓度大于9.2mol/L | B. | 溶液体积为20mL | ||
| C. | 溶质质量分数为49% | D. | 溶质质量分数小于49% |
| A. | MnO2→Mn2+ | B. | PCl3→PCl5 | C. | HCl→H2 | D. | H2O2→O2 |
| A. | 新制的氯水在光照条件下颜色变浅 | |
| B. | 高压对合成氨有利 | |
| C. | 将NO2和N2O4的混合气体降温后,气体颜色变浅 | |
| D. | 加入催化剂能使合成氨的速率加快 |
| A. | 非金属性:A>B | |
| B. | 四种元素中,C处于元素周期表中最左、下方,故原子半径最大 | |
| C. | 元素B和C只能形成一种化合物 | |
| D. | A、C、D的最高价氧化物对应的水化物中没有两性氢氧化物 |
| A. | 金属氧化物一定是碱性氧化物,非金属氧化物一定是酸性氧化物 | |
| B. | 碱性氧化物一定是金属氧化物 | |
| C. | 碱性氧化物都能与水化合生成碱 | |
| D. | 酸性氧化物一定是非金属氧化物 |
国(湖南)国际矿物宝石博览会.矿博会上展示了色彩缤纷、形状各异的金属矿物,下
列金的冶炼属于热还原法的是( )
| A. | 2NaCl(熔融)=2Na+Cl2↑ | B. | WO3+3H2 $\frac{\underline{\;△\;}}{\;}$ W+3H2O | ||
| C. | Fe+CuSO4=Cu+FeSO4 | D. | 2Ag2O $\frac{\underline{\;△\;}}{\;}$4Ag+O2↑ |