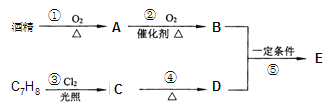
题目内容
【题目】实验室制Cl2反应为4HCl(浓)+MnO2![]() MnCl2+Cl2↑+2H2O下列说法不正确的是
MnCl2+Cl2↑+2H2O下列说法不正确的是
A. 还原剂是HCl,氧化剂是MnO2
B. 每生成1 mol Cl2,转移的电子数为2 NA
C. 转移电子的物质的量为1 mol时,生成标准状况下Cl2的体积为11.2 L
D. 每消耗1 mol MnO2,起还原剂作用的HCl消耗4 mol
【答案】D
【解析】
4HCl(浓)+MnO2![]() MnCl2+Cl2↑+2H2O中,Mn元素的化合价由+4降低为+2价,Cl元素的化合价由-1价升高为0,该反应转移2e-,以此来解答。
MnCl2+Cl2↑+2H2O中,Mn元素的化合价由+4降低为+2价,Cl元素的化合价由-1价升高为0,该反应转移2e-,以此来解答。
A.Mn元素的化合价降低,Cl元素的化合价升高,则还原剂是HCl,氧化剂是MnO2,选项A正确;
B.每生成1 molCl2,转移电子的物质的量为1mol×2×(1-0)=2 mol,转移的电子数为2 NA,选项B正确;
C.转移电子的物质的量为1mol时,生成氯气为0.5mol,标准状况下Cl2的体积为11.2L,选项C正确;
D.由反应方程式可知,HCl一半起酸性作用,一半作还原剂,则每消耗1 mol MnO2,起还原剂作用的HCl消耗2 mol,选项D错误。
答案选D。

练习册系列答案
 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案
相关题目