题目内容
2.化学与生活密切相关,下列说法不正确的是( )| A. | Na2O2可用作供氧剂 | |
| B. | 硅胶多孔,吸水能力强,常用作袋装食品的干燥剂 | |
| C. | SO2具有漂白性,常用药食品的漂白 | |
| D. | K2FeO4可用于水的净化 |
分析 A.过氧化钠可与二氧化碳、水反应生成氧气;
B.硅胶具有吸附性,可用作干燥剂;
C.二氧化硫对人体有害,不能用于漂白食品;
D.K2FeO4具有强氧化性,可用于杀菌消毒,还原产物可水解生成具有吸附性的氢氧化铁胶体.
解答 解:A.过氧化钠可与二氧化碳、水反应生成氧气,则可用作供氧剂,故A正确;
B.硅胶多空,具有吸附性,可用作干燥剂,故B正确;
C.二氧化硫对人体有害,只能用于工业漂白,不能用于漂白食品,故C错误;
D.K2FeO4具有强氧化性,可用于杀菌消毒,还原产物可水解生成具有吸附性的氢氧化铁胶体,可净水,除去水中的悬浮物,故D正确.
故选C.
点评 本题考查较为综合,为高频考点,侧重于化学与生活的考查,有利于培养学生的良好的科学素养,难度不大,注意相关知识的积累.

练习册系列答案
相关题目
12.在下列化合物:①CH3-CH3 ②CH2=CH2 ③ ④
④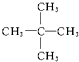 ⑤
⑤ ⑥CH3-CH═CH2 ⑦
⑥CH3-CH═CH2 ⑦ ⑧
⑧ ⑨
⑨ 中,属于环状化合物的是③⑤⑦⑧⑨,属于脂环化合物的是⑤⑦,属于芳香化合物的是③⑧⑨,属于脂肪烃的是①②④⑥.
中,属于环状化合物的是③⑤⑦⑧⑨,属于脂环化合物的是⑤⑦,属于芳香化合物的是③⑧⑨,属于脂肪烃的是①②④⑥.
 ④
④ ⑤
⑤ ⑥CH3-CH═CH2 ⑦
⑥CH3-CH═CH2 ⑦ ⑧
⑧ ⑨
⑨ 中,属于环状化合物的是③⑤⑦⑧⑨,属于脂环化合物的是⑤⑦,属于芳香化合物的是③⑧⑨,属于脂肪烃的是①②④⑥.
中,属于环状化合物的是③⑤⑦⑧⑨,属于脂环化合物的是⑤⑦,属于芳香化合物的是③⑧⑨,属于脂肪烃的是①②④⑥.
13.下列说法正确的是( )
| A. | 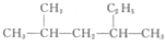 的名称为2-甲基-4-乙基戊烷 的名称为2-甲基-4-乙基戊烷 | |
| B. |  互为同分异构体 互为同分异构体 | |
| C. | 糖类、油脂、蛋白质的水解产物都是非电解质 | |
| D. | 用浸泡过高锰酸钾溶液的硅藻土保鲜水果 |
10. 苯甲酸叶醇酯存在于麝香、百合和水仙花中,可用于高档香水的香精配方中,留香时间超过两周,其结构简式如图所示,下列关于苯甲酸叶醇酯的说法中错误的是( )
苯甲酸叶醇酯存在于麝香、百合和水仙花中,可用于高档香水的香精配方中,留香时间超过两周,其结构简式如图所示,下列关于苯甲酸叶醇酯的说法中错误的是( )
 苯甲酸叶醇酯存在于麝香、百合和水仙花中,可用于高档香水的香精配方中,留香时间超过两周,其结构简式如图所示,下列关于苯甲酸叶醇酯的说法中错误的是( )
苯甲酸叶醇酯存在于麝香、百合和水仙花中,可用于高档香水的香精配方中,留香时间超过两周,其结构简式如图所示,下列关于苯甲酸叶醇酯的说法中错误的是( )| A. | 苯甲酸叶醇酯能发生氧化反应 | |
| B. | 苯甲本叶醇酯能使溴的四氯化碳溶液褪色 | |
| C. | 1mol苯甲酸叶醇酯最多能与4molH2发生加成反应 | |
| D. | 1mol苯甲酸叶醇酯与NaOH溶液反应时,能消耗2molNaOH |
17.偏二甲肼( )是运载火箭的主体燃料.C2H8N2物质中含碳碳单键的同分异构体共有( )
)是运载火箭的主体燃料.C2H8N2物质中含碳碳单键的同分异构体共有( )
 )是运载火箭的主体燃料.C2H8N2物质中含碳碳单键的同分异构体共有( )
)是运载火箭的主体燃料.C2H8N2物质中含碳碳单键的同分异构体共有( )| A. | 2种 | B. | 3 种 | C. | 4种 | D. | 5种 |
7.氮和硅均是自然界含量非常丰富的元素.
(1)氮化硅陶瓷是一种新型无机非金属材料,其化学式为Si3N4
(2)向大气中排放NOx可能导致的环境问题有酸雨、光化学烟雾、臭氧层破坏(任一点均可).(任答一点)用足量NaOH溶液能完全吸收NO2生成NaNO2、NaNO3和H2O2.试写出该反应的离子方程式:2NO2+2OH-═NO3-+NO2-+H2.
(3)高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料.工业上提纯硅有多种技术路线,其中一种工艺流程如图1:
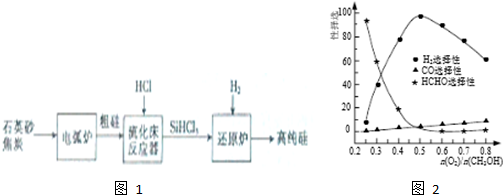
①电弧炉中发生的主要反应的化学方程式为SiO2+3C$\frac{\underline{\;高温\;}}{\;}$SiC+2CO↑.
②在流化床反应的产物中,SiHCl3大约占85%,还有SiCl4、SiH2Cl2、SiH3Cl等,有关物质的沸点数据如下表,提纯SiHCl3的主要工艺操作依次是沉降、冷凝和精馏(或蒸馏).
(4)“硅能源”有望成为二十一世纪的新能源.1mol硅完全燃烧能放出910kJ的热量,写出该反应的热化学方程式:Si(S)+O2(g)═SiO2(S)△H=-910KJ/mol;与“氢能源”比较“硅能源”具有的优点是产物不污染环境,储存、运输方便.
(5)工业上常利用甲醇部分氧化法制备氢气.在一定温度下以Ag/CeO2-SiO2为催化剂时原料气比例对反应选择性(选择性越大,表示生成的该物质越多)影响关系如图2所示.则当$\frac{n({O}_{2})}{n(C{H}_{3}OH)}$=0.25时,CH3OH与O2发生的主要反应方程式为2CH3OH+O2$→_{△}^{催化剂}$2HCHO+2H2O;当$\frac{n({O}_{2})}{n(C{H}_{3}OH)}$>0.5时,H2选择性下降的原因氧气过量,与氢气反应生成水.
(1)氮化硅陶瓷是一种新型无机非金属材料,其化学式为Si3N4
(2)向大气中排放NOx可能导致的环境问题有酸雨、光化学烟雾、臭氧层破坏(任一点均可).(任答一点)用足量NaOH溶液能完全吸收NO2生成NaNO2、NaNO3和H2O2.试写出该反应的离子方程式:2NO2+2OH-═NO3-+NO2-+H2.
(3)高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料.工业上提纯硅有多种技术路线,其中一种工艺流程如图1:

①电弧炉中发生的主要反应的化学方程式为SiO2+3C$\frac{\underline{\;高温\;}}{\;}$SiC+2CO↑.
②在流化床反应的产物中,SiHCl3大约占85%,还有SiCl4、SiH2Cl2、SiH3Cl等,有关物质的沸点数据如下表,提纯SiHCl3的主要工艺操作依次是沉降、冷凝和精馏(或蒸馏).
| 物质 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
| 沸点/℃ | 2355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 | -111.9 |
(5)工业上常利用甲醇部分氧化法制备氢气.在一定温度下以Ag/CeO2-SiO2为催化剂时原料气比例对反应选择性(选择性越大,表示生成的该物质越多)影响关系如图2所示.则当$\frac{n({O}_{2})}{n(C{H}_{3}OH)}$=0.25时,CH3OH与O2发生的主要反应方程式为2CH3OH+O2$→_{△}^{催化剂}$2HCHO+2H2O;当$\frac{n({O}_{2})}{n(C{H}_{3}OH)}$>0.5时,H2选择性下降的原因氧气过量,与氢气反应生成水.
14.酸雨这一环境污染现象是因为过度燃烧煤及石油产生的,某次酸雨分析结果如下:c(NH4+)=2.0×10-6mol/L;c(Cl-)=6.0×10-6mol/L;c(Na+)=3.0×10-6mol/L;c(NO3-)=2.3×10-5mol/L;c(SO42-)=2.8×10-5mol/L.则此次酸雨的pH为( )
| A. | 2~3之间 | B. | 3~4之间 | C. | 4~5之间 | D. | 5~6之间 |
11.25℃时进行四组实验,其中“实验内容”与对应“现象或结论”关系错误的是( )
| 选项 | 实验内容 | 现象或结论 |
| A | 向2SO2+O2?2SO3的平衡体系中加入由18O构成的氧气 | 则SO2中的18O的含量会增加 |
| B | 向pH=1的盐酸和醋酸各0.5L的溶液中各加入1.4g铁粉 | 醋酸中生成H2的速率快且最终气体量多 |
| C | 以石墨为电极,电解KI溶液(其中含有少量酚酞和淀粉) | 阴极逸出气体且附近溶液渐呈红色 |
| D | 以Pb为负极,硫酸溶液为电解质的铅蓄电池,在放电过程中 | 负极质量增加,SO42-向负极迁移,溶液pH增大 |
| A. | A | B. | B | C. | C | D. | D |
12.下列物质中,属于电解质的是( )
| A. | NH3 | B. | 铜 | C. | 酒精 | D. | 硫酸 |