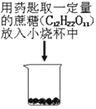
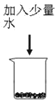
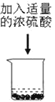
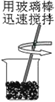
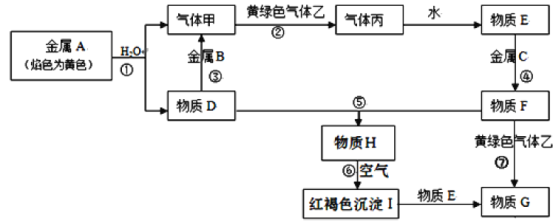
题目内容
【题目】下列离子组在给定条件下离子共存判断及反应的离子方程式均正确的是( )
选项 | 条件 | 离子组 | 离子共存判断及反应的离子方程式 |
A | 滴加氨水 | Na+、Al3+、Cl-、NO3- | 不能大量共存,Al3++3OH-=Al(OH)3↓ |
B | 由水电离出的H+浓度为1×10-12molL-1 |
| 一定能大量共存
|
C | pH=1的溶液 | Fe2+、Al3+、 | 不能大量共存,5Fe2++ |
D | 通入少量SO2气体 | K+、Na+、ClO-、 | 不能大量共存,2ClO-+SO2+H2O=2HClO+ |
A.AB.BC.CD.D
【答案】C
【解析】
A.离子之间不发生任何反应,可大量共存,但加入氨水生成沉淀,由于一水合氨为弱电解质,发生Al3++3NH3·H2O═Al(OH)3↓+3NH4+,故A错误;
B.由水电离出的H+浓度为1×10-12mol·L-1,水的电离受到抑制,溶液可能呈酸性,也可能呈碱性,碱性条件下NH4+不能大量共存,故B错误;
C.pH=1的溶液呈酸性,酸性条件下Fe2+与MnO4-发生氧化还原反应,反应的离子方程式为5Fe2++MnO4-+8H+═Mn2++5Fe3++4H2O,故C正确;
D.SO2具有还原性,与ClO-发生氧化还原反应,反应的离子方程式为ClO-+SO2+H2O═2H++Cl-+SO42-,故D错误。
故选:C。

【题目】室温下,某一元弱酸HA的电离常数K=1.6×10-6。向20.00mL浓度约为0.1mol·L-1 HA溶液中逐滴加入0.1000mol·L-1的标准NaOH溶液,其pH变化曲线如图所示(忽略温度变化)。请回答下列有关问题:
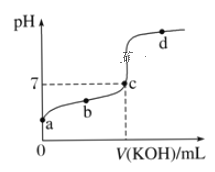
(1)a、b、c、d四点中水的电离程度最大的是_______点,滴定过程中宜选用__________作指示剂,滴定终点在__________(填“c点以上”或“c点以下”)。
(2)滴定过程中部分操作如下,下列各操作使测量结果偏高的是_____(填字母序号)。
A.滴定前碱式滴定管未用标准NaOH溶液润洗
B.用蒸馏水洗净锥形瓶后,立即装入HA溶液后进行滴定
C.滴定过程中,溶液出现变色后,立即停止滴定
D.滴定结束后,仰视液面,读取NaOH溶液体积
(3)若重复三次滴定实验的数据如下表所示,计算滴定所测HA溶液的物质的量浓度为_____mol/L。(保留4位有效数字)
实验序号 | NaOH溶液体积/mL | 待测HA溶液体积/mL |
1 | 21.01 | 20.00 |
2 | 20.99 | 20.00 |
3 | 21.60 | 20.00 |
(4)a点溶液中pH约为________,此时溶液中H2O电离出的c(H+)为________。