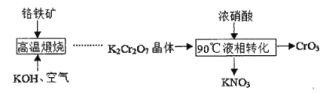
题目内容
【题目】在化学课上围绕浓硫酸的化学性质进行了如下实验探究,将适量的蔗糖放入烧杯中,加入少量水,搅拌均匀,然后加入浓硫酸,快速搅拌,生成疏松多孔的黑色物质。
(1) 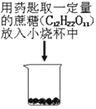 (2)
(2) 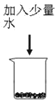 (3)
(3) 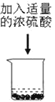 (4)
(4)  (5)
(5) 
请回答下列问题:
①根据上述实验步骤(1)-(5)中,蔗糖与浓硫酸反应的实验现象,浓硫酸表现出的化学性质有____________ (填字母)。
A.酸性 B.吸水性 C.脱水性 D.强氧化性
②反应中生成的黑色物质继续与浓硫酸作用,产生两种气体,其中一种气体 X 有刺激性气味,另一种气体 Y 无色无味,写出反应的化学方程式_____________。
③为了在混合气体中检验出 X、Y 这两种气体,提供下列试剂:(试剂可多次使用,不考虑尾气处理)
A.品红溶液 B.澄清石灰水 C.酸性高锰酸钾溶液 D.氢氧化钠溶液
气体通过的顺序依次是:____________→____________→____________→____________ (填字母)。证明有气体 Y 存在的实验现象为____________。
【答案】BCD C+2H2SO4(浓)=CO2↑+2SO2↑+2H2O A C A B 澄清石灰水变浑浊
【解析】
浓硫酸溶于水放出大量的热,蔗糖脱水生成碳,生成的碳与浓硫酸反应生成二氧化碳、二氧化硫和水;混合气体的成分是是二氧化碳和二氧化硫,先检验二氧化硫,再检验二氧化碳。
(1)①将适量的蔗糖放入烧杯中,加入少量水,然后加入浓硫酸,生成黑色物质碳表现了浓硫酸的脱水性,浓硫酸吸收水放出大量的热,碳与浓硫酸在加热的条件下反应,生成两种气体,体现了浓硫酸的吸水性和强氧化性;
②黑色物质继续与浓硫酸作用,产生两种气体,其中一种气体 X 有刺激性气味,是大气的污染物之一,这种刺激性气味的气体是SO2,另一种无色无味气体Y是CO2,反应的化学方程式为:C+2H2SO4(浓)=CO2↑+2SO2↑+2H2O;
③先将混合气体通入品红溶液检验二氧化硫,品红溶液褪色,含有二氧化硫,从品红溶液中出来的气体通入酸性高锰酸钾溶液,酸性高锰酸钾溶液颜色变浅,这一步除去二氧化硫,通过酸性高锰酸钾溶液出来的气体再通入品红溶液,品红溶液不变色,证明二氧化硫除尽,再通入澄清石灰水,若有白色沉淀生成,则含有二氧化碳。故气体通过的顺序依次是:A→C→A→B;

【题目】下列离子组在给定条件下离子共存判断及反应的离子方程式均正确的是( )
选项 | 条件 | 离子组 | 离子共存判断及反应的离子方程式 |
A | 滴加氨水 | Na+、Al3+、Cl-、NO3- | 不能大量共存,Al3++3OH-=Al(OH)3↓ |
B | 由水电离出的H+浓度为1×10-12molL-1 |
| 一定能大量共存
|
C | pH=1的溶液 | Fe2+、Al3+、 | 不能大量共存,5Fe2++ |
D | 通入少量SO2气体 | K+、Na+、ClO-、 | 不能大量共存,2ClO-+SO2+H2O=2HClO+ |
A.AB.BC.CD.D