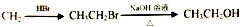题目内容
硫酸是强酸,中学阶段将硫酸在水溶液中看作完全电离.但事实是,硫酸在水中的第一步电离是完全的,第二步电离并不完全,其电离情况为:H2SO4═H++HSO4-,HSO4?H++SO42-.
请回答下列有关问题:
(1)K2SO4溶液呈 (填“弱酸性”、“中性”或“弱碱性”),其理由是 (用离子方程式表示).
(2)NaHSO4溶液与NaHCO3溶液反应的离子方程式为 .
(3)若25℃时,0.10mol?L-1的NaHSO4溶液中c(SO42-)=0.029mol?L-1,则0.10mol?L-1的H2SO4溶液中c(H+) 0.129mol?L-1(填“>”、“=”或“<”).
(4)已知在酸性条件下2Cu+=Cu2++Cu,写出Cu2O与稀硫酸反应的离子方程式 ,Cu2O与浓硫酸共热的化学方程式 .
请回答下列有关问题:
(1)K2SO4溶液呈
(2)NaHSO4溶液与NaHCO3溶液反应的离子方程式为
(3)若25℃时,0.10mol?L-1的NaHSO4溶液中c(SO42-)=0.029mol?L-1,则0.10mol?L-1的H2SO4溶液中c(H+)
(4)已知在酸性条件下2Cu+=Cu2++Cu,写出Cu2O与稀硫酸反应的离子方程式
考点:盐类水解的应用
专题:盐类的水解专题
分析:(1)硫酸根离子水解、钾离子不水解导致溶液呈弱碱性;
(2)二者反应生成硫酸根离子、水和二氧化碳;
(3)硫酸第一步电离出的氢离子抑制第二步电离;
(4)Cu2O与稀硫酸反应生成硫酸铜、Cu和水,Cu2O与浓硫酸共热生成硫酸铜、二氧化硫和水.
(2)二者反应生成硫酸根离子、水和二氧化碳;
(3)硫酸第一步电离出的氢离子抑制第二步电离;
(4)Cu2O与稀硫酸反应生成硫酸铜、Cu和水,Cu2O与浓硫酸共热生成硫酸铜、二氧化硫和水.
解答:
解:(1)硫酸根离子水解、钾离子不水解导致溶液呈弱碱性,水解方程式为SO42-+H2O?HSO4-+OH-,故答案为:弱碱性;SO42-+H2O?HSO4-+OH-;
(2)二者反应生成硫酸根离子、水和二氧化碳,离子方程式为HSO4-+HCO3-=H2O+CO2↑+SO42-,故答案为:HSO4-+HCO3-=H2O+CO2↑+SO42-;
(3)硫酸第一步电离出的氢离子抑制第二步电离,所以0.10mol?L-1的H2SO4溶液中c(H+)<0.129mol?L-1,故答案为:<;
(4)Cu2O与稀硫酸反应生成硫酸铜、Cu和水,离子方程式为Cu2O+2H+=Cu+Cu2++H2O,Cu2O与浓硫酸共热生成硫酸铜、二氧化硫和水,离子方程式为Cu2O+3H2SO4(浓)
2CuSO4+SO2↑+3H2O,
故答案为:Cu2O+2H+=Cu+Cu2++H2O;Cu2O+3H2SO4(浓)
2CuSO4+SO2↑+3H2O.
(2)二者反应生成硫酸根离子、水和二氧化碳,离子方程式为HSO4-+HCO3-=H2O+CO2↑+SO42-,故答案为:HSO4-+HCO3-=H2O+CO2↑+SO42-;
(3)硫酸第一步电离出的氢离子抑制第二步电离,所以0.10mol?L-1的H2SO4溶液中c(H+)<0.129mol?L-1,故答案为:<;
(4)Cu2O与稀硫酸反应生成硫酸铜、Cu和水,离子方程式为Cu2O+2H+=Cu+Cu2++H2O,Cu2O与浓硫酸共热生成硫酸铜、二氧化硫和水,离子方程式为Cu2O+3H2SO4(浓)
| ||
故答案为:Cu2O+2H+=Cu+Cu2++H2O;Cu2O+3H2SO4(浓)
| ||
点评:本题考查了盐类水解、氧化还原反应等知识点,注意:硫酸第一步完全电离、第二步部分电离,所以硫酸根离子只有第一步水解,溶液中不存在硫酸分子,为易错点.

练习册系列答案
 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案
相关题目
A、B、C、D四种短周期元素的原子半径依次减小,A与C的核电荷数之比为3:4,D能分别与A、B、C形成电子总数相等的分子X、Y、Z,下列叙述正确的是( )
| A、X、Y、Z的稳定性逐渐增强 |
| B、X、Y、Z三种化合物的熔沸点逐渐升高 |
| C、A、B、C、D只能形成四种单质 |
| D、只含有A、B、C、D 四种元素的化合物有两种 |
下列说法正确的是( )
| A、金属钠着火可用煤油扑灭 |
| B、将几滴FeCl3饱和溶液滴入氢氧化钠溶液可制备Fe(OH)3胶体 |
| C、向含有等量NaI、NaCl的溶液中滴加AgNO3溶液,先产生白色沉淀 |
| D、用浓氢氧化钠溶液和湿润红色石蕊试纸检验某溶液中是否有NH4+ |
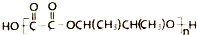 的合成路线流程图(无机试剂任用).合成路线流程图如图:
的合成路线流程图(无机试剂任用).合成路线流程图如图: