题目内容
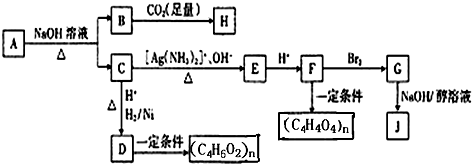
由A、B两种粉末组成的混合物,在一定条件能发生如图所示的转化关系.其中B、C均为氧化物,J为黄绿色气体,部分反应产物已略去.
请回答:
(1)写出相应物质的化学式:A ,B
(2)写出图中相应转化的离子方程式:反应② 反应③
(3)反应①的主要用途是 (回答一条即可).
(4)以下选项中的试剂可以检验溶液F中的金属阳离子的是 (填字母编号).
a.NaOH溶液 b.KSCN溶液 c.稀硫酸 d.新制氯水与KSCN溶液.

请回答:
(1)写出相应物质的化学式:A
(2)写出图中相应转化的离子方程式:反应②
(3)反应①的主要用途是
(4)以下选项中的试剂可以检验溶液F中的金属阳离子的是
a.NaOH溶液 b.KSCN溶液 c.稀硫酸 d.新制氯水与KSCN溶液.
考点:无机物的推断
专题:推断题
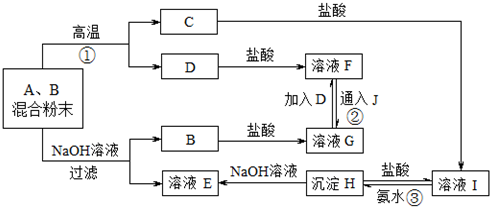
分析:解题的第一个“突破口”是J在常温下是黄绿色气体,J为Cl2,由A、B两种粉末组成的混合物,在高温下能反应生成CD,且B、C均为氧化物,该反应为铝热反应的特征,则A为Al,B为金属性弱于铝的金属氧化物,又由F、G的转化可知,D为变价金属,则D为Fe,F为FeCl2,G为FeCl3,则B为Fe2O3,A+B→C+D反应为:Fe2O3+2Al
Al2O3+2Fe,C为Al2O3,C→I反应为:Al2O3+6HCl═2AlCl3+3H2O,I为AlCl3,I→H反应为:AlCl3+3NH3?H2O=Al(OH)3↓+3NH4Cl沉淀H为Al(OH)3,H→E反应为:Al(OH)3+NaOH═NaAlO2+2H2O,A、B两种粉末组成的混合物与氢氧化钠溶液作用,发生:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;B→G发生反应为:Fe2O3+6HCl═2FeCl3+3H2O,D→F反应为:Fe+2HCl═FeCl2+H2↑,F→G反应为:2FeCl2+Cl2=2FeCl3,G→F反应为:Fe+2FeCl3=3FeCl2,以此解答该题.
| ||
解答:
解:解题的第一个“突破口”是J在常温下是黄绿色气体,J为Cl2,由A、B两种粉末组成的混合物,在高温下能反应生成CD,且B、C均为氧化物,该反应为铝热反应的特征,则A为Al,B为金属性弱于铝的金属氧化物,又由F、G的转化可知,D为变价金属,则D为Fe,F为FeCl2,G为FeCl3,则B为Fe2O3,A+B→C+D反应为:Fe2O3+2Al
Al2O3+2Fe,C为Al2O3,C→I反应为:Al2O3+6HCl═2AlCl3+3H2O,I为AlCl3,I→H反应为:AlCl3+3NH3?H2O=Al(OH)3↓+3NH4Cl沉淀H为Al(OH)3,H→E反应为:Al(OH)3+NaOH═NaAlO2+2H2OE为NaAlO2,A、B两种粉末组成的混合物与氢氧化钠溶液作用,发生:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;B→G发生反应为:Fe2O3+6HCl═2FeCl3+3H2O,D→F反应为:Fe+2HCl═FeCl2+H2↑,F→G反应为:2FeCl2+Cl2=2FeCl3,G→F反应为:Fe+2FeCl3=3FeCl2,
推出A为Al,B为Fe2O3,C为Al2O3,D为Fe,E为NaAlO2,F为FeCl2,G为FeCl3,H为Al(OH)3,I为AlCl3,J为Cl2,
(1)由以上分析可知A为Al,B为Fe2O3,
故答案为:Al;Fe2O3;
(2)反应②为F→G2FeCl2+Cl2=2FeCl3,离子反应为:2Fe2++Cl2═2Fe3++2Cl-,反应③为I→H:AlCl3+3NH3?H2O=Al(OH)3↓+3NH4Cl,离子反应为:Al3++3NH3?H2O═Al (OH)3↓+3NH4+,
故答案为:2Fe2++Cl2═2Fe3++2Cl-;Al3++3NH3?H2O═Al (OH)3↓+3NH4+;
(3)反应①为Fe2O3+2Al
Al2O3+2Fe,属于铝热反应,其原理是活泼金属在高温下置换出其它金属,重要用途是焊接钢轨或冶炼难熔金属,
故答案为:焊接钢轨或冶炼难熔金属;
(4)F为FeCl2,
a.向某溶液中加入NaOH溶液得白色沉淀,又观察到颜色逐渐变为红褐色,白色氢氧化亚铁被氧化为红褐色氢氧化铁,说明该溶液中含有Fe2+,故a正确;
b.亚铁离子与硫氰化钾溶液不作用,无法检验,故b错误;
c.稀硫酸与亚铁离子不作用,无法检验,故c错误;
d.Fe2+与KSCN溶液反应无血红色出现,但Fe3+与KSCN反应产生血红色,加新制氯水与KSCN溶液,氯水氧化亚铁离子生成三价铁离子产生血红色,故d正确;
故答案为:ad;
| ||
推出A为Al,B为Fe2O3,C为Al2O3,D为Fe,E为NaAlO2,F为FeCl2,G为FeCl3,H为Al(OH)3,I为AlCl3,J为Cl2,
(1)由以上分析可知A为Al,B为Fe2O3,
故答案为:Al;Fe2O3;
(2)反应②为F→G2FeCl2+Cl2=2FeCl3,离子反应为:2Fe2++Cl2═2Fe3++2Cl-,反应③为I→H:AlCl3+3NH3?H2O=Al(OH)3↓+3NH4Cl,离子反应为:Al3++3NH3?H2O═Al (OH)3↓+3NH4+,
故答案为:2Fe2++Cl2═2Fe3++2Cl-;Al3++3NH3?H2O═Al (OH)3↓+3NH4+;
(3)反应①为Fe2O3+2Al
| ||
故答案为:焊接钢轨或冶炼难熔金属;
(4)F为FeCl2,
a.向某溶液中加入NaOH溶液得白色沉淀,又观察到颜色逐渐变为红褐色,白色氢氧化亚铁被氧化为红褐色氢氧化铁,说明该溶液中含有Fe2+,故a正确;
b.亚铁离子与硫氰化钾溶液不作用,无法检验,故b错误;
c.稀硫酸与亚铁离子不作用,无法检验,故c错误;
d.Fe2+与KSCN溶液反应无血红色出现,但Fe3+与KSCN反应产生血红色,加新制氯水与KSCN溶液,氯水氧化亚铁离子生成三价铁离子产生血红色,故d正确;
故答案为:ad;
点评:本题考查无机物的推断,为高频考点,侧重于学生的分析能力的考查,题目难度中等,本题注意把握信息中的题眼,为解答该题的关键,在平时学习中要多总结,勤反思,熟练掌握物质的特征反应现象、产物颜色、反应变化等知识,构建物质之间转化关系的网络图,这样解答类似题目将很顺手.

练习册系列答案
 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案
相关题目
2Al2O3
4Al+3O2↑,当产生2mol Al时,转移的电子数为( )
| ||
| A、2mol | B、6mol |
| C、12mol | D、24mol |
下列说法不正确的是( )
| A、人体缺碘会引起大脖子病,缺铁会引起贫血 |
| B、硅是构成一些岩石和矿物的基本元素 |
| C、NaHCO3受热易分解放出CO2,常用于制作糕点 |
| D、将Na2SO4分入钠盐和硫酸盐的分类方法属于树状分类法 |
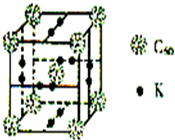 碳、氢、氟、氮、硅等非金属元素与人类的生产生活息息相关.回答下列问题:
碳、氢、氟、氮、硅等非金属元素与人类的生产生活息息相关.回答下列问题: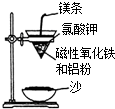 某校高三同学高考前重做以下两个课本实验,请你回答实验过程中的相关问题:
某校高三同学高考前重做以下两个课本实验,请你回答实验过程中的相关问题: