题目内容
A、B、C、D四种短周期元素的原子半径依次减小,A与C的核电荷数之比为3:4,D能分别与A、B、C形成电子总数相等的分子X、Y、Z,下列叙述正确的是( )
| A、X、Y、Z的稳定性逐渐增强 |
| B、X、Y、Z三种化合物的熔沸点逐渐升高 |
| C、A、B、C、D只能形成四种单质 |
| D、只含有A、B、C、D 四种元素的化合物有两种 |
考点:原子结构与元素周期律的关系
专题:元素周期律与元素周期表专题
分析:A、B、C、D四种短周期元素的原子半径依次减小,A与C核电荷数之比为3:4,A、C只能为同周期元素,两元素有Li和Be、C和O、Mg和S,D能分别与A、B、C形成电子总数相等的分子X、Y、Z,考虑10电子微粒,可推知A为C元素,C为O元素,D为H元素,则B为N元素,X、Y、Z分别为CH4、NH3、H2O,结合元素周期律及物质性质解答.
解答:
解:A、B、C、D四种短周期元素的原子半径依次减小,A与C核电荷数之比为3:4,A、C只能为同周期元素,两元素有Li和Be、C和O、Mg和S,D能分别与A、B、C形成电子总数相等的分子X、Y、Z,考虑10电子微粒,可推知A为C元素,C为O元素,D为H元素,则B为N元素,X、Y、Z分别为CH4、NH3、H2O,
A.同周期随原子序数增大,非金属性增强,所以非金属性C<N<O,非金属性越强,氢化物越稳定,所以CH4、NH3、H2O的稳定性逐渐增强,故A正确;
B.常温下水为液态,而甲烷、氨气为气体,水的沸点最高,氨气分子之间存在氢键,沸点比甲烷高,故CH4、NH3、H2O的沸点逐渐升高,故B正确;
C.碳元素、氧元素存在同素异形体,四元素形成的单质多于四种,故C错误;
D.四元素组成的化合物除常见的碳酸铵、碳酸氢铵外,有机物中硝基化合物、硝酸酯、氨基酸、蛋白质等均属于C、H、O、N组成的化合物,故D错误,
故选:AB.
A.同周期随原子序数增大,非金属性增强,所以非金属性C<N<O,非金属性越强,氢化物越稳定,所以CH4、NH3、H2O的稳定性逐渐增强,故A正确;
B.常温下水为液态,而甲烷、氨气为气体,水的沸点最高,氨气分子之间存在氢键,沸点比甲烷高,故CH4、NH3、H2O的沸点逐渐升高,故B正确;
C.碳元素、氧元素存在同素异形体,四元素形成的单质多于四种,故C错误;
D.四元素组成的化合物除常见的碳酸铵、碳酸氢铵外,有机物中硝基化合物、硝酸酯、氨基酸、蛋白质等均属于C、H、O、N组成的化合物,故D错误,
故选:AB.
点评:本题考查原子结构、元素周期律的有关知识,难度中等,推断元素是解题关键,A、C核电荷数关系是突破口,D选项中注意考虑有机物.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A、1mol FeCl3完全水解转化为氢氧化铁胶体后能生成NA个胶粒 |
| B、标准状况下,2.24L NO2中含分子数有0.1NA个 |
| C、常温常压下,44g CO2中含有22NA个电子 |
| D、1mol?L-1 NaCl溶液含阴阳离子总数有2NA个 |
对于苯乙烯(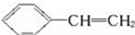 )的下列叙述:①使溴水反应褪色;②可发生加聚反应;③可溶于苯中;④可溶于水;⑤能发生取代反应;⑥所有的原子可能共平面.其中完全正确的是( )
)的下列叙述:①使溴水反应褪色;②可发生加聚反应;③可溶于苯中;④可溶于水;⑤能发生取代反应;⑥所有的原子可能共平面.其中完全正确的是( )
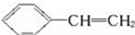 )的下列叙述:①使溴水反应褪色;②可发生加聚反应;③可溶于苯中;④可溶于水;⑤能发生取代反应;⑥所有的原子可能共平面.其中完全正确的是( )
)的下列叙述:①使溴水反应褪色;②可发生加聚反应;③可溶于苯中;④可溶于水;⑤能发生取代反应;⑥所有的原子可能共平面.其中完全正确的是( )| A、①②③⑤⑥ | B、①②⑤⑥ |
| C、①②④⑤ | D、①②③④⑤⑥ |
往相同浓度、相同体积的NaOH溶液中分别加入pH为3和4的醋酸,使其刚好完全反应,若消耗两种醋酸溶液的体积分别为V1和V2,则V1、V2的关系是( )
| A、V2=10V1 |
| B、V2<10V1 |
| C、V2>10V1 |
| D、V1=10V2 |
氢氟酸(HF)对玻璃有腐蚀作用,可用在玻璃上雕刻各种精美图案,也可用在玻璃仪器上标注刻度及文字.氢氟酸与玻璃发生的反应可以表示为:SiO2+4HF=X↑+2H2O,关于物质X的组成,下列说法正确的是( )
| A、可能含有氢元素 |
| B、可能含有氧元素 |
| C、一定含有硅元素、氟元素 |
| D、X是一种氧化物 |
2Al2O3
4Al+3O2↑,当产生2mol Al时,转移的电子数为( )
| ||
| A、2mol | B、6mol |
| C、12mol | D、24mol |
用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A、0.1mol Fe在0.1mol Cl2中充分燃烧,转移的电子数为0.3NA |
| B、标准状况下,11.2L CCl4所含分子数约为0.5NA |
| C、常温下,pH=13的NaOH溶液中,OH-的数目为0.1NA |
| D、常温、常压下,14g CO与N2的混合气含的原子数为NA |
同浓度同体积的醋酸与盐酸相比,下列既能表明醋酸是弱酸,又能表明盐酸是强酸的是( )
| A、c(H+):盐酸大于醋酸 |
| B、盐酸中:c(H+)=c(Cl-),醋酸中:c(H+)<c(CH3COOH) |
| C、c(Cl-)>c(CH3COO-) |
| D、盐酸中:无氯化氢分子;醋酸中:存在大量醋酸分子 |