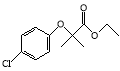
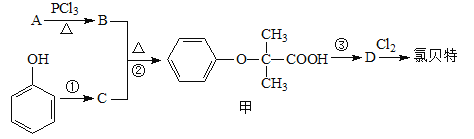
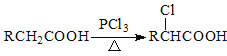
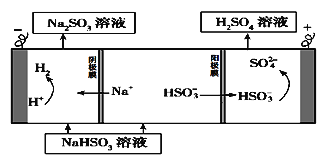
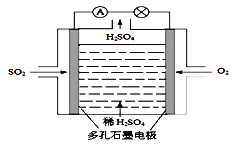
题目内容
【题目】以0.100 0 mol·L-1 NaOH溶液滴定c mol·L-1某弱酸HA溶液,其滴定曲线如图所示。下列说法正确的是
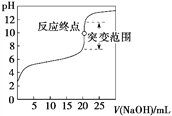
A. 可用甲基橙作滴定指示剂(已知甲基橙的变色范围为3.1~4.4,pH<3.1时溶液为红色,pH>4.4时溶液为黄色)
B. 指示剂指示的滴定终点就是反应终点
C. 突变范围的大小与酸的强弱及酸的浓度有关
D. 滴定时氢氧化钠溶液盛放在带活塞的滴定管中
【答案】C
【解析】A、氢氧化钠和弱酸恰好反应生成的盐是强碱弱酸盐,盐水解显碱性,应选择碱性条件下变色的指示剂,不能选择甲基橙,应选择酚酞指示剂,A错误;B、反应终点是指酸和碱刚好完全反应,而指示剂是一个变色范围,B错误;C、当酸的酸性很强,浓度变稀时突变范围增大,突变范围的大小与酸的强弱及酸的浓度有关,C正确;D、带活塞的为酸式滴定管不能盛氢氧化钠溶液,滴定时氢氧化钠溶液盛放在碱式滴定管中,D错误;答案选C。

 阅读快车系列答案
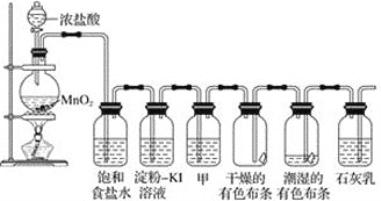
阅读快车系列答案【题目】某化学兴趣小组制取氯酸钾和氯水并进行有关探究实验。
实验一 制取氯酸钾和氯水
利用下图所示的实验装置进行实验。
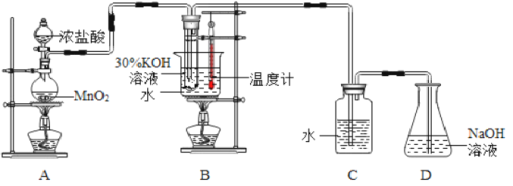
(1)制取实验结束后,取出B中试管冷却结晶,过滤,洗涤。过滤操作过程中需要的玻璃仪器有__________。
(2)若对调B和C装置的位置,_____(填“能”或“不能”)提高B中氯酸钾的产率。D装置的作用是___________________。
(3)在实验过程中,若要检验C装置的瓶塞处是否密封好,请简述化学检验方案_______。
实验二 氯酸钾与碘化钾反应的研究
(4)在不同条件下KClO3可将KI氧化为I2或KIO3.该小组设计了系列实验研究反应条件对反应产物的影响,其中系列a实验的记录如下(实验在室温下进行):
试管编号 | 1 | 2 | 3 | 4 |
0.2molL﹣1KI/mL | 1.0 | 1.0 | 1.0 | 1.0 |
KClO3(s)/g | 0.10 | 0.10 | 0.10 | 0.10 |
6.0molL﹣1H2SO4/mL | 0 | 3.0 | 6.0 | 9.0 |
蒸馏水/mL | 9.0 | 6.0 | 3.0 | 0 |
实验现象 |
①系列a实验的实验目的是___________________________。
②设计1号试管实验的作用是__________________________。
③若2号试管实验现象为"黄色溶液",取少量该溶液加入淀粉溶液显蓝色;假设氧化产物唯一,还原产物为KCl,则此反应的离子方程式为__________________________。
p>实验三 测定饱和氯水中氯元素的总量(5)根据下列资料,为该小组设计一个可行的实验方案(不必描述操作过程的细节):____。
资料:i.次氯酸会破坏酸碱指示剂;
ii.次氯酸或氯气可被SO2、H2O2和FeCl2等物质还原成Cl﹣。