题目内容
【题目】某学习小组以SO2为原料,采用电化学方法制取硫酸。
(1)原电池原理:该小组设计的原理示意图如左下图,写出该电池负极的电极反应式______。
(2)电解原理:该小组用Na2SO3溶液充分吸收SO2得到NaHSO3溶液,然后电解该溶液制得了硫酸。原理如右下图,写出开始电解时阳极的电极反应式________________。
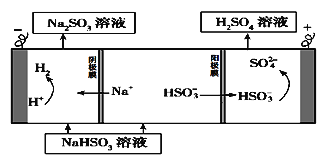
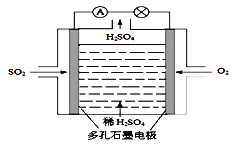
【答案】 SO2-2e-+2H2O=SO42-+4H+ HSO3--2e-+H2O= SO42-+3H+
【解析】试题分析:(1)原电池总反应为2SO2+ O2+2H2O= 2H2SO4,原电池负极失电子发生氧化反应,正极得电子发生还原反应;(2)NaHSO3溶液电解生成硫酸,硫元素化合价升高发生氧化反应;
解析:(1) 该电池中SO2失电子发生氧化反应,所以该电池负极的电极反应式SO2-2e-+2H2O=SO42-+4H+;(2) NaHSO3溶液电解生成硫酸,硫元素化合价升高发生氧化反应,电解池阳极HSO3-失电子发生氧化反应,所以阳极的电极反应式HSO3--2e-+H2O= SO42-+3H+。

 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案 名校联盟快乐课堂系列答案
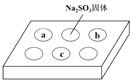
名校联盟快乐课堂系列答案【题目】某同学进行SO2的性质实验。在点滴板a、b、c处分别滴有不同的试剂,再向Na2SO3固体上滴加数滴浓H2SO4后,在整个点滴板上盖上培养皿,一段时间后观察到的实验现象如下表所示。
序号 | 试剂 | 实验现象 |
|
a | 品红溶液 | 红色褪去 | |
b | 酸性KMnO4溶液 | 紫色褪去 | |
c | NaOH溶液(含2滴酚酞) | 红色褪去 |
下列说法正确的是
A. 浓硫酸与Na2SO3固体发生了氧化还原反应
B. a、b均表明SO2具有漂白性
C. c中只可能发生反应:SO2+ 2OH—= SO32—+ H2O
D. c中所得溶液的离子浓度一定存在关系:c(Na+)+c(H+) = 2c(SO32—) +c(HSO3) + c(OH)