题目内容
【题目】某化学兴趣小组欲在实验室探究氯气的性质及模拟工业制取漂白粉,设计了如下装置进行实验。
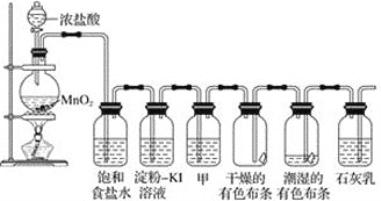
请按要求回答下列问题:
(1)饱和食盐水的作用是_______________________________;
(2)淀粉-KI溶液中观察到的现象是_____________,反应的离子方程式为_______________。
(3)若干燥的有色布条不褪色,湿润的有色布条褪色,由该现象可得出的结论是___________________甲中盛放的试剂是____________。
(4)Cl2与石灰乳反应制取漂白粉的离子方程式为________________________;
(5)该兴趣小组用17.4 g 二氧化锰与足量的浓盐酸制备氯气,反应的离子方程为____________,理论上最多可制得标准状况下氯气的体积是_______L。
【答案】除去Cl2中混有的HCl 溶液变蓝色 Cl2+2I-=2Cl-+I2 干燥的氯气不具有漂白性,氯气与水反应生成的次氯酸具有漂白性 浓硫酸 Cl2+Ca(OH)2=Ca2++Cl-+ClO-+H2O MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O 4.48
Mn2++Cl2↑+2H2O 4.48
【解析】
发生装置中通过二氧化锰和浓盐酸加热反应生成氯气,氯气中含氯化氢和水蒸气,通过饱和食盐水除去氯化氢,通过淀粉碘化钾溶液变蓝,通过甲洗气瓶中的浓硫酸干燥氯气,通过干燥的有色布条不变化,通过湿润的有色布条会褪色,最后通过石灰乳反应生成漂白粉,据此解答。
(1)浓盐酸和二氧化锰加热反应生成氯化锰、氯气和水,制备的氯气中含氯化氢气体和水蒸气,通过饱和食盐水可以除去Cl2中混有的HCl;
(2)氯气氧化性强于碘,能够与碘化钾反应生成碘,碘遇到淀粉变蓝,反应的离子方程式为Cl2+2I-=2Cl-+I2;
(3)若干燥的有色布条不褪色,湿润的有色布条褪色,由于氯气与水反应生成盐酸和次氯酸,因此由该现象可得出的结论是干燥的氯气不具有漂白性,氯气与水反应生成的次氯酸具有漂白性。氯气是酸性气体,因此甲中盛放的试剂是浓硫酸,用来干燥氯气;
(4)Cl2与石灰乳反应制取漂白粉的离子方程式为Cl2+Ca(OH)2=Ca2++Cl-+ClO-+H2O;
(5)根据反应MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O可知反应的离子方程为MnO2+4H++2Cl-
MnCl2+Cl2↑+2H2O可知反应的离子方程为MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O。17.4g二氧化锰的物质的量是17.4g÷87g/mol=0.2mol,则理论上完全反应生成氯气0.2mol,标况下气体体积为0.2mol×22.4L/mol=4.48L。
Mn2++Cl2↑+2H2O。17.4g二氧化锰的物质的量是17.4g÷87g/mol=0.2mol,则理论上完全反应生成氯气0.2mol,标况下气体体积为0.2mol×22.4L/mol=4.48L。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】下表是元素周期表的一部分,请回答有关问题:
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ | ⑩ |
(1)表中化学性质最不活泼的元素,其原子结构示意图为 ________ ;
(2)表中能形成两性氢氧化物的元素是 ________ (用元素符号表示),写出该元素的单质与⑨最高价氧化物的水化物反应的化学方程式:_________;
(3)③⑦⑩三种元素的阴离子还原性顺序为: ___________________;⑦的水溶液呈__________色 ;
(4)①、②、⑥、⑦四种元素的最高价氧化物的水化物中酸性最强的是 _______(填化学式) ;
(5)③元素与⑩元素两者核电荷数之差是 ____________ ;
(6)设计实验方案:比较⑦与⑥单质氧化性的强弱,请将方案填入下表。
实验步骤 | 实验现象与结论 |
____________________ | ____________________ |