题目内容
【题目】下列说法中正确的是( )
A.SO2、CO2、SiO2中的S、C、Si均为sp3杂化
B.H3O+、NH4+、[Cu(NH3)4]2+均含有配位键
C.SO32—、CO32—、SiO32—均为平面三角形
D.石墨、新型高分子导电材料、聚乙烯、金属晶体均含有金属键
【答案】B
【解析】
试题分析:A.CO2、SiO2中的C、Si的价层电子对数为4,均为sp3杂化,SO2中S原子的价层电子对数为2+![]() (6-2×2)=3,为sp2杂化,故A错误;B.在物质或离子中中心原子含有空轨道,和含有孤电子对的原子或离子能形成配位键,所以H3O+、NH4+、[Cu(NH3)4]2+均含有配位键,故B正确;C.SO32-中S原子的价层电子对数为3+
(6-2×2)=3,为sp2杂化,故A错误;B.在物质或离子中中心原子含有空轨道,和含有孤电子对的原子或离子能形成配位键,所以H3O+、NH4+、[Cu(NH3)4]2+均含有配位键,故B正确;C.SO32-中S原子的价层电子对数为3+![]() (6+2-2×3)=4,含有一个孤电子对,属于三角锥形,CO32-中C原子的价层电子对数为3+
(6+2-2×3)=4,含有一个孤电子对,属于三角锥形,CO32-中C原子的价层电子对数为3+![]() (4+2-2×3)=3,没有孤电子对,为平面三角形,SiO32-为平面三角形,故C错误;D.金属单质中含有金属键,石墨、新型高分子导电材料聚乙炔中含有共价键,没有金属键,故D错误;故选B。
(4+2-2×3)=3,没有孤电子对,为平面三角形,SiO32-为平面三角形,故C错误;D.金属单质中含有金属键,石墨、新型高分子导电材料聚乙炔中含有共价键,没有金属键,故D错误;故选B。

 阅读快车系列答案
阅读快车系列答案【题目】用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
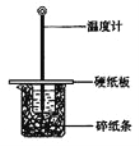
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是 。
(2)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大、偏小、无影响”)
(3)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等、不相等”),所求中和热△H_____ (填“相等、不相等”)
(4)如果用相同浓度和体积的氨水代替NaOH溶液进行上述实验,所求的中和热△H会 (填“偏大”、“偏小”、“无影响”) 若用KOH代替NaOH,实验所测的热量会_________________(填“偏大”、“偏小”、“无影响”)。
(5)他们记录的实验数据如下:
实验用品[ | 溶液温度 | 中和热 △H | |||
起始平 均温度 | 反应最高温度 | ||||
① | 50mL,0.55mol.L-1NaOH | 50mL,0.5mol.L-1HCl | 20℃ | 23.3℃ | |
② | 50mL,0.55mol.L-1NaOH | 50mL,0.5mol.L-1HCl | 20℃ | 23.5℃ | |
已知反应后溶液的比热容C为4.18KJ·℃-1· Kg-1,各物质的密度均视为1g·cm-3。
①根据上表数据计算中和热△H=__________(保留至小数点后一位)
②根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式: 。
(6)上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是(填字母)_______________。
A.实验装置保温、隔热效果差
B.量取稀盐酸溶液的体积时仰视读数
C.一次性把NaOH溶液倒入盛有盐酸的小烧杯中
D.用温度计测定NaOH溶液起始温度后直接测定HCl溶液的温度