题目内容
【题目】研究CO2的综合利用对促进“低碳经济”的发展有重要意义。CO2与H2合成二甲醚(CH3OCH3)是一种CO2转化方法,其过程中主要发生下列反应:
反应I CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1= -49.0 kJ.mol-1
CH3OH(g)+H2O(g) △H1= -49.0 kJ.mol-1
反应II 2CH3OH(g)![]() CH3OCH3(g)+H20(g) △H2=- 24.5 kJ.mol-1
CH3OCH3(g)+H20(g) △H2=- 24.5 kJ.mol-1
反应III CO2(g)+H2(g)![]() CO(g)+H2O(g) △H3=41.2 kJ.mol-1
CO(g)+H2O(g) △H3=41.2 kJ.mol-1
(1)写出CO2与H2一步合成二甲醚(反应IV)的热化学反应方程式:_______________
(2)有利于提高反应IV平衡转化率的条件是_______。
A.高温高压 B.低温诋压 C.高温低压 D.低温高压
(3)在恒压、CO2和H2起始物质的量之比为1:3的条件下,CO2平衡转化率和平衡时二甲醚的选择性随温度的变化如图1。CH3OCH3的选择性=![]()
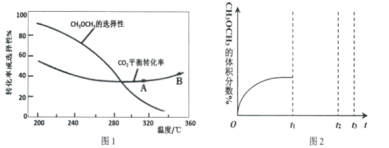
①温度低于300℃,CO2平衡转化率随温度升高而下降的原因是_____________________
②关于合成二甲醚工艺的理解,下列说法正确的是_____________
A.反应IV在A点和B点时的化学平衡常数K(A)小于K(B)
B.当温度、压强一定时,在原料气(CO2和H2的比例不变)中添加少量惰性气体,有利于提高平衡转化率
C.其他条件不变,在恒容条件下的二甲醚平衡选择性比恒压条件下的平衡选择性低
D.提高催化剂的活性和选择性,减少CO等副产物是工艺的关键
③在某温度下,若加入CO2的物质的量为1mol,生成二甲醚的选择性为80%,现收集到0.2mol的二甲醚,则CO2转化率为__________________
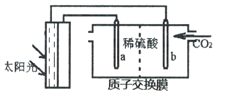
④一定温度压强下,二甲醚的体积分数随时间变化如图2所示。在t1时刻,再加入物质的量之比为1:3的CO2和H2,t2时刻重新达到平衡。画出t1—t3时刻二甲醚体积分数的变化趋势。__________________
(4)光能储存一般是指将光能转换为电能或化学能进行储存,利用太阳光、CO2、H2O生成二甲醚的光能储存装置如图所示,则b极的电极反应式为____________________
【答案】2CO2(g)+6H2(g) ![]() CH3OCH3(g)+3H2O(g) ΔH=-122.5kJ·mol-1 D 反应Ⅲ的ΔH >0,温度升高,二氧化碳的平衡转化率变大,而反应Ⅰ(或者反应Ⅳ)的ΔH <0,温度升高,二氧化碳的平衡转化率下降,且上升幅度小于下降幅度; CD 50%或0.5
CH3OCH3(g)+3H2O(g) ΔH=-122.5kJ·mol-1 D 反应Ⅲ的ΔH >0,温度升高,二氧化碳的平衡转化率变大,而反应Ⅰ(或者反应Ⅳ)的ΔH <0,温度升高,二氧化碳的平衡转化率下降,且上升幅度小于下降幅度; CD 50%或0.5 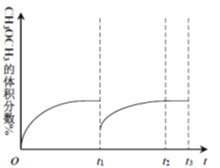 12H++2CO2+12e-=CH3OCH3+3H2O
12H++2CO2+12e-=CH3OCH3+3H2O
【解析】
(1)根据盖斯定律分析,反应I CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1= -49.0 kJ.mol-1, 反应II 2CH3OH(g)
CH3OH(g)+H2O(g) △H1= -49.0 kJ.mol-1, 反应II 2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H2=- 24.5 kJ.mol-1,有I ×2+II得热化学方程式2CO2(g)+6H2(g)
CH3OCH3(g)+H2O(g) △H2=- 24.5 kJ.mol-1,有I ×2+II得热化学方程式2CO2(g)+6H2(g) ![]() CH3OCH3(g)+3H2O(g) ΔH=-49.0×2- 24.5=-122.5kJ·mol-1;
CH3OCH3(g)+3H2O(g) ΔH=-49.0×2- 24.5=-122.5kJ·mol-1;
(2)反应IV为放热反应,A.高温平衡逆向移动,高压平衡正向移动,故此条件不能确定平衡的移动方向,不能确定是否提高转化率,故错误;B.低温平衡正向移动,低压平衡逆向移动,故不能确定是否提高转化率,故错误;C.高温平衡逆向移动,低压平衡逆向移动,转化率降低,故错误;D.低温高压都能使平衡正向移动,提高转化率,故正确。
(3)①反应Ⅲ的ΔH >0,温度升高,平衡正向移动,二氧化碳的平衡转化率变大,而反应Ⅰ(或者反应Ⅳ)的ΔH <0,温度升高,平衡逆向移动,二氧化碳的平衡转化率下降,且上升幅度小于下降幅度,所以随着温度升高,二氧化碳的平衡转化率下降;
②A.从图分析反应IV随着温度升高,二氧化碳的平衡转化率A点小于B点,但二甲醚的选择性降低,说明反应IV进行程度减小,所以在A点和B点时的化学平衡常数K(A)大于K(B),故错误;
B.当温度、压强一定时,在原料气(C02和H2的比例不变)中添加少量惰性气体,容器的体积增大,相当于减压,平衡逆向移动,不有利于提高平衡转化率,故错误;
C.其他条件不变,在恒容条件下反应体系中的压强逐渐减小,二甲醚平衡选择性比恒压条件下的平衡选择性低,故正确;
D.提高催化剂的活性和选择性,可以控制三个反应是否进行,减少CO等副产物是工艺的关键,故正确;故选CD。
③生成二甲醚的选择性为80%,现收集到0.2mol的二甲醚,说明有0.4mol二氧化碳转化生成二甲醚,生成二甲醚的选择性为80%,即有0.5mol二氧化碳参与反应,则二氧化碳的转化率为![]() =50%或0.5。
=50%或0.5。
④反应到平衡后,在t1时刻,再加入物质的量之比为1:3的CO2和H2,加入时二甲醚的体积分数减小,平衡正向移动,二甲醚的体积分数逐渐增加,因为是在恒温恒压条件下,再加入等物质的量比的二氧化碳和氢气,所以属于等效平衡,即平衡时二甲醚的体积分数不变。所以图像如下: 。
。
④该装置为电解装置,二氧化碳变成二甲醚是得到电子的过程,根据图中质子交换膜分析,反应中的离子只能写氢离子,所以电极反应为12H++2CO2+12e-=CH3OCH3+3H2O。

【题目】由下列实验及现象能推出相应结论的是
实验操作及实验现象 | 结 论 | |
A | 向2mL 0.5mol/L FeCl3溶液中滴加2mL 1mol/L KSCN溶液,振荡后静置,观察到溶液变成红色,加入1mL 2mol/L KCl溶液后溶液红色变浅 | c(KCl)增大使该反应[FeCl3+ 3KSCN |
B | 向做了相同标记的2支试管中均加入2mL 0.1mol/L Na2S2O3溶液,再分别向2支试管中加入4mL浓度为0.1mol/L、0.5mol/L 的H2SO4溶液,测定恰好遮挡全部标记所用时间 | 其他条件一定时,反应物浓度越大,化学反应速率越快 |
C | 室温下,用广泛pH试纸测定0.1 mol/L Na2SO3溶液的pH为10,0.1mol/L NaHSO3溶液的pH为5 | 相同条件下,HSO3-的水解能力强于SO32- |
D | 向2 mL0.1mol/LAgNO3溶液中加入1mL0.1mol/LNaCl溶液,生成白色沉淀,再加入1mL0.1mol/L KI溶液,生成黄色沉淀 | Ksp(AgI)<Ksp(AgCl) |
A.AB.BC.CD.D