题目内容
【题目】常温下,现有0.1mol/LNH4HCO3溶液,溶液pH为7.8。已知含氮(或含碳)各微粒的分布分数(平衡时某种微粒的浓度占各种微粒浓度之和的分数)与pH的关系如图所示。下列说法不正确的是

A.NH4HCO3溶液中存在下列关系:c(NH4+)+c(NH3·H2O)=c(HCO3-)+c(CO32-)+c(H2CO3)
B.当溶液的pH=9时,溶液中存在下列关系:c(HCO3-)>c(NH4+)>c(NH3·H2O)>c(CO32-)
C.向该溶液中加入少量氢氧化钠固体时,c(HCO3-)、c(NH4+)均减小
D.通过分析可知常温下Kb(NH3·H2O)<Ka1(H2CO3)
【答案】D
【解析】
A. 溶液中并且存在物料守恒:c(NH4+)+c(NH3·H2O)=c(HCO3-)+c(CO32-)+c(H2CO3),故A正确;
B. 结合图象可知,溶液的pH=9时,溶液中离子浓度大小为c(HCO3-)>c(NH4+)>c(NH3·H2O)>c(CO32-),故B正确;
C. 逐滴滴加氢氧化钠溶液时,c(HCO3)先逐渐增大,当pH大于7.8后随溶液pH增大时,铵根离子浓度逐渐减小,而此时碳酸氢根离子仍在增大,稍后才开始减小,故C正确;
D. 常温下,0.1 moI/L的NH4HCO3溶液,pH=7.8.溶液显碱性,说明碳酸氢根离子水解程度大于铵根离子,越弱越水解,则Kb(NH3H2O)>Ka1(H2CO3),故D错误;
答案选D。

 阅读快车系列答案
阅读快车系列答案【题目】某兴趣小组利用以下实验装置模拟工业炼铁的主要过程:
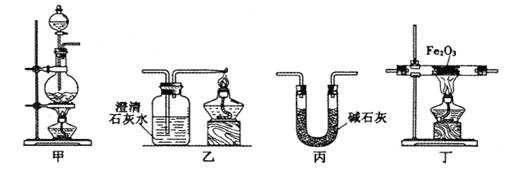
(1)装置甲中发生的反应为:HCOOH(甲酸)![]() CO↑+H2O。已知甲酸是一种无色有刺激性气味的液体。制取一氧化碳时应该______________(填字母)。
CO↑+H2O。已知甲酸是一种无色有刺激性气味的液体。制取一氧化碳时应该______________(填字母)。
a.将甲酸滴入浓硫酸 b.将浓硫酸滴入甲酸 c.将甲酸与浓硫酸混合后加入
(2)请按合适的顺序连接好以下装置:甲→(_____)→(_____)→(_____)
(3)丙装置中碱石灰的作用是__________________________。
(4)实验将近完成时,熄灭装置甲、乙、丁中酒精灯的先后顺序为__________。
(5)为了探究影响反应产物的外界因素,在Fe2O3,与CO反应部位,该小组同学分别用酒精灯和酒精喷灯进行了两次实验,结果如下:
加热方式 | 通CO加热时间/min | 澄清石灰水变浑浊时间/min | 产物颜色 | 产物能否全部被磁铁吸引 |
酒精灯 | 30 | 5 | 黑色 | 能 |
酒精喷灯 | 30 | 1 | 黑色 | 能 |
①甲同学猜想黑色产物中可能含有碳单质。乙同学排除了该可能,他提出的两种理由是:____、____。
②丙同学查找资料发现,Fe3O4也能被磁铁吸引,对黑色产物成分提出以下三种假设:i.全部为铁;ii.________;iii.___________。
③通过进一步定量实验,黑色产物所含元素组成和质量分数如下:
样品序号 | 加热方式 | 元素组成和质量分数 |
产物样品I | 酒精灯 | w(Fe)=74.4%、w(O)=25.6% |
产物样品II | 酒精喷灯 | w(Fe)=100% |
样品I的成分及质量分数为______________________。
【题目】二氧化碳的回收利用对温室气体的减排具有重要的意义。在2L密闭容器中,加入2.00molCO2和2.0 mol H2以及催化剂发生反应:CO2(g)+H2 (g)![]() HCOOH(g) ΔH,测得,n(H2)/mol在不同温度随时间的变化如下表:
HCOOH(g) ΔH,测得,n(H2)/mol在不同温度随时间的变化如下表:
60 min | 90 min | 120 min | 150 min | 180 min | ||
实验I | Tl/K | 1.50 mol | 1.32 mol | 1.28 mol | 1.26 mol | 1.26 mol |
实验Ⅱ | T2/K | 1.45 mol | 1.20 mol | 1.10 mol | 1.10 mol | 1.10 mol |
(1)比较实验温度T1___T2(填“>”、“<”),该反应的ΔH___0(填“>”、“=”、“<”)。
(2)实验I中0~60 min内用HCOOH表示的该反应的平均反应速率为_____。
(3)实验Ⅱ反应开始时体系压强为P0,第90min时体系压强为Pl,则Pl∶P0=___。
(4)比较实验I、Ⅱ在80min时的逆反应速率大小vl___vⅡ(填“>”、“<”或“无法判断”),原因是_____。