题目内容
【题目】实验室制备三氯乙醛(CCl3CHO)的反应原理为C2H5OH+4Cl2→CCl3CHO+5HCl,可能发生的副反应是C2H5OH+HCl→C2H5Cl+H2O。某探究小组模拟制备三氯乙醛的实验装置如图所示(夹持、加热装置均略去)。
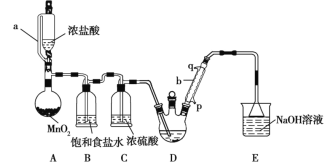
回答下列问题:
(1)用仪器a代替普通分液漏斗的目的是_______________。
(2)装置A中MnO2可以用KMnO4代替,反应可以在常温下进行,试写出反应的离子方程式________________。
(3)仪器b中冷凝水应从_______(填“p”或“q”)口进。
(4)若撤去装置B,对实验的影响是______________。
(5)已知:CCl3CHO+OH-→CHCl3+HCOO-;HCOO-+I2=H++2I-+CO2↑;I2+2S2O32-=2I-+S4O62-。称取0.40 g产品,配成待测溶液,加入20.00 mL 0.100 mol/L碘标准溶液,再加入适量Na2CO3溶液,反应完全后,加盐酸调节溶液的pH,并立即用0.020 mol/L的Na2S2O3溶液滴定至终点。重复上述操作3次,平均消耗Na2S2O3溶液20.00 mL。滴定时所用指示剂是________,达到滴定终点时的现象是______________,测得该产品的纯度为_____。若滴定管用蒸馏水洗净后没有用Na2S2O3溶液润洗,则测定结果将_______(填“偏大”、“偏小”或“不变”)。
【答案】平衡气压,便于液体顺利滴下 【答题空2】2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O 【答题空3】p Cl2中的氯化氢杂质与乙醇反应,生成氯乙烷,导致三氯乙醛的纯度降低 淀粉溶液 滴入最后一滴 Na2S2O3 溶液,锥形瓶中的溶液由蓝色变为无色,且半分钟内不变色 【答题空7】66.4%或66% 偏小
【解析】
A装置利用二氧化锰与浓盐酸制备氯气,B装置用饱和食盐水除去HCl,C装置盛放浓硫酸干燥氯气,D中反应制备CCl3CHO,E装置盛放氢氧化钠溶液,吸收尾气中氯气、HCl,防止污染空气。
(1)根据仪器a的结构确定a的名称;
(2)二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气与水;
(3)冷凝管中水流方向与气流方向相反;
(4)撤去B装置,增大副反应C2H5OH+HCl→C2H5Cl+H2O的发生;
(5)碘遇淀粉溶液变蓝色,滴加Na2S2O3溶液会导致碘被还原,溶液的颜色会变浅,最终消失,根据消耗的Na2S2O3计算剩余I2的物质的量,进而计算与HCOO-反应的I2的物质的量,再根据关系式:CCl3CHO~HCOO-~I2计算。
(1)仪器a为恒压分液漏斗可以使浓盐酸溶液的液面上下气体压强一致,漏斗中的液体在重力作用下就可以顺利滴下;
(2)装置A中MnO2可以用KMnO4代替,反应可以在常温下进行,KMnO4将HCl氧化为Cl2,它本身被还原变为Mn2+,根据电子守恒、电荷守恒及原子守恒,可得反应的离子方程式:反应方程式为:2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O;
(3)为了增强冷凝效果,要根据逆流原理,冷凝管中冷却水流方向为低进高出,即p进q出;
(4)B装置用饱和食盐水除去HCl,减少副反应发生,若撤去B装置,氯气中混有HCl,会增大副反应C2H5OH+HCl→C2H5Cl+H2O的发生,导致装置D中副产物C2H5Cl增多,三氯乙醛的纯度降低;
(5)根据碘遇淀粉溶液变蓝色的性质,可选择淀粉作指示剂,在滴加Na2S2O3溶液时,当观察到溶液蓝色变为无色,且半分钟内不变色,此时达到滴定终点;若滴定管用蒸馏水洗净后没有用Na2S2O3溶液润洗,则标准溶液的浓度偏小,根据标准溶液中含有的溶质物质的量计算的结构就会偏小;n(S2O32-)=0.020 mol/L×0.020L=4×10-4mol,剩余I2的物质的量n(I2)=![]() n(S2O32-)=2×10-4mol,与HCOO-反应的I2的物质的量为0.100mol/L×0.02L-2×10-4mol=1.8×10-3mol,由CCl3CHO~HCOO-~I2可知,CCl3CHO的物质的量n(CCl3CHO)= n(I2)=1.8×10-3mol,则该产品的纯度为
n(S2O32-)=2×10-4mol,与HCOO-反应的I2的物质的量为0.100mol/L×0.02L-2×10-4mol=1.8×10-3mol,由CCl3CHO~HCOO-~I2可知,CCl3CHO的物质的量n(CCl3CHO)= n(I2)=1.8×10-3mol,则该产品的纯度为![]() =66.4%,或写为66%。
=66.4%,或写为66%。

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案【题目】Ⅰ、实验室要配制物质的量浓度为0.1 mol/L的NaOH溶液480 mL
(1)填表:
配制时应称量NaOH的质量/g | 已给仪器 | 配制时除已给仪器外还需要的其他仪器 |
__________ | 烧杯、药匙、托盘天平 | ____________________________ |
(2)若要计算该溶液溶质的质量分数,还需要的一个条件是______________(用文字说明)。
(3)下列操作对配制的NaOH溶液浓度有偏高影响的是_________________(填字母)
A.称量NaOH固体时,露置在空气的时间过长
B.选用的容量瓶内有少量的蒸馏水
C.在烧杯中溶解NaOH后,立即将所得溶液注入容量瓶中
D.在定容时仰视容量瓶刻度线
Ⅱ、实验室用下图几个实验装置,可快速制取少量气体,并进行相关性质实验。

(1)若 A为30%H2O2溶液,B为MnO2 ,C盛有氢硫酸(H2S)饱和溶液,旋开E后,C中出现浅黄色浑浊的现象,写出C中发生反应的化学方程式:______________________________________。
(2)若A中装有浓盐酸,B中装有固体KMnO4 ,C中盛有KI淀粉溶液,旋开E后,B中出现黄绿色气体。已知1 mol KMnO4发生反应时转移5mol电子。则B中发生反应的离子方程式是:_______;C中的现象是:___________。