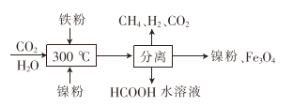
题目内容
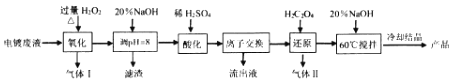
【题目】碱式硫酸铬[Cr(OH)SO4nH2O]常用于鞣制皮革,染料工业的活性黑染料、媒染剂。电镀废水中(主要含Cr2O72-、Cr3+、Fe3+、CN-、Cl-,少量Mg2+、Cu2+等离子),提取含铬废水中的铬并制成可用的碱式硫酸铬对污染治理和工业生产具有十分重要的意义。
相关金属离子[co (Mn+)= 01 molL-1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Cr3+ | Fe3+ | Mg2+ | Cu2+ |
开始沉淀的pH | 4.3 | 1.9 | 9.1 | 4.7 |
沉淀完全的pH | 5.6 | 3.2 | 11.1 | 6.7 |
回答下列问题:
(1)碱式硫酸铬中Cr的化合价为_________。
(2)“氧化”时需控制反应温度在50℃~90℃,原因___________。H2O2先将CN-氧化为无害气体除去,气体I成分是________;后在碱性条件下将Cr3+ 氧化为CrO42-,滤渣中主要含________ (填相关物质的化学式)。
(3)“酸化”时CrO42-可转化为Cr2O72-,其离子方程式为________。
(4)“离子交换”过程采用钠离子交换树脂,反应原理为Mn+ +nNaR=MRn+nNa+ ,则富集到钠离子交换树脂上的金属阳离子有_________(填离子符号)。
(5)处理1L0.1molL-1Cr2O72- 的废水,理论上需要H2C2O4的物质的量为_______ mol。
(6)废水中含有的Cl-常以K2CrO4溶液为指示剂,用AgNO3标准溶液滴定测其含量,利用Ag+与CrO42-生成的砖红色沉淀指示到达滴定终点。当溶液中Cl- 恰好完全沉淀(浓度等于1.0×10一5molL-1)时,溶液中c (Ag+)为_____molL-1 此时溶液中c(CrO42-)等于_______mo1L-1(已知Ag2CrO4、AgCl的Ksp分别约为2.0×10-12和和2.0×10 -10)。
【答案】+3 一是加快反应速率,二是防止温度过高H2O2分解耗量增多 CO2、N2 Fe(OH)3、Cu(OH)2 2CrO42- +2H+ Cr2O72- + H2O Mg2+ 0.3 2.0×10-5 5.0×10-3
【解析】
电镀废水中主要含Cr2O72-、Cr3+、Fe3+、CN-、Cl-,少量Mg2+、Cu2+等离子,“氧化”过程中H2O2先将CN-氧化为无害气体除去,后在碱性条件下将Cr3+ 氧化为CrO42-;然后加入20%NaOH溶液调节溶液的pH=8,根据各离子开始沉淀和完全沉淀的pH,Fe3+、Cu2+转化成Fe(OH)3、Cu(OH)2沉淀而除去;滤液中含CrO42-、Cl-、Mg2+,滤液中加入稀硫酸酸化,CrO42-转化为Cr2O72-,通过离子交换膜除去滤液中的Mg2+;加入草酸还原Cr2O72-,Cr2O72-还原成Cr3+,草酸被氧化成CO2;含Cr3+溶液中加入20%NaOH充分反应、冷却结晶获得产品;结合相关化学用语和原理作答。
(1)碱式硫酸铬的化学式为Cr(OH)SO4nH2O,其中H、O、S的化合价依次为+1价、-2价、+6价,则Cr的化合价为+3价。
(2)“氧化”时加入氧化剂H2O2,H2O2不稳定易分解成H2O和O2,则“氧化”时需控制反应温度在50℃~90℃的原因是:加快反应速率(因为温度过低反应速率太慢),防止温度过高H2O2分解耗量增多;H2O2先将CN-氧化为无害气体除去,其中C元素被氧化成CO2、N元素被氧化成N2,反应的方程式为5H2O2+2CN-=2CO2↑+N2↑+2OH-+4H2O,气体I成分是CO2、N2;H2O2后在碱性条件下将Cr3+ 氧化为CrO42-,反应的方程式为3H2O2+2Cr3++10OH-=2CrO42-+8H2O,因为调节溶液的pH=8,根据各离子开始沉淀和完全沉淀的pH,Fe3+、Cu2+转化成Fe(OH)3、Cu(OH)2沉淀而除去,则滤渣中主要含Fe(OH)3、Cu(OH)2。
(3)“酸化”时CrO42-可转化为Cr2O72-,结合原子守恒和酸性条件,离子方程式为2CrO42-+2H+Cr2O72-+H2O。
(4)根据上述分析,富集到钠离子交换树脂上的金属阳离子为Mg2+。
(5)还原过程中Cr2O72-还原成Cr3+,草酸被氧化成CO2,Cr元素的化合价由+6价降为+3价,C元素的化合价由+3价升为+4价,根据得失电子守恒,0.1mol/L×1L×2×3=n(H2C2O4)×2×1,解得n(H2C2O4)=0.3mol。
(6)根据Ksp(AgCl)=c(Ag+)·c(Cl-),当溶液中Cl- 恰好完全沉淀(浓度等于1.0×10-5mol·L-1)时,溶液中c (Ag+)为![]() mol/L=2.0×10-5mol/L;根据Ksp(Ag2CrO4)=c2(Ag+)·c(CrO42-),此时溶液中c(CrO42-)等于
mol/L=2.0×10-5mol/L;根据Ksp(Ag2CrO4)=c2(Ag+)·c(CrO42-),此时溶液中c(CrO42-)等于 mol/L=5.0×10-3mol/L。
mol/L=5.0×10-3mol/L。