题目内容
【题目】常温下,用 0.1 mol·L-1 KOH 溶液滴定 10 mL 0.1 mol·L-1 HA(Ka =1.0×10-5)溶液的滴定曲线如图所示。下列说法正确的是( )
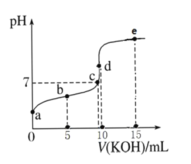
A.a 点溶液的 pH 约为 5
B.水的电离程度:c 点>d 点
C.b 点溶液中粒子浓度大小: c(A-)>c(K+)>c(HA)>c(H+)>c(OH-)
D.e 点溶液中:c(K+)=2c(A-)+2c(HA)
【答案】C
【解析】
A. a点溶液为0.1 mol·L-1 HA溶液,HA![]() H++A-,
H++A-,![]() ,溶液中
,溶液中![]() ,所以溶液pH约为3,A错误;
,所以溶液pH约为3,A错误;
B. c点溶液pH=7,溶质为HA、KA,d点溶液的溶质为KA,HA电离抑制水的电离,KA水解促进水的电离,则水的电离程度:d点>c点,B错误;
C. b点溶液中,溶质为等物质的量的HA、KA,HA![]() H++A-,A-+H2O
H++A-,A-+H2O![]() HA+OH-,溶液显酸性,则HA的电离程度大于A-的水解程度,所以溶液中粒子浓度大小:c(A-)>c(K+)>c(HA)>c(H+)>c(OH-),C正确;
HA+OH-,溶液显酸性,则HA的电离程度大于A-的水解程度,所以溶液中粒子浓度大小:c(A-)>c(K+)>c(HA)>c(H+)>c(OH-),C正确;
D. e点溶液中的溶质为KA、KOH,且c(KA)=2c(KOH),根据物料守恒,c(KA)=c(A-)+c(HA),则2c(K+)=2c(KA)+2c(KOH)=3c(KA)=3c(A-)+3c(HA),D错误;
故答案为:C。

 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案【题目】(1)根据氯化铁溶液回答下列问题:
①向FeCl3溶液中加入少量NaHCO3。产生的现象为___。用离子方程式表示其原因___。
②不断加热FeCl3溶液蒸干其水分并灼烧,得到的固体是___。
③在配制FeCl3溶液时,为防止溶液变浑浊,应加入___。
(2)利用反应Cu+H2O2+H2SO4=CuSO4+2H2O设计一个原电池,回答下列问题:
①负极材料为___;正极反应式为___。
②反应过程中SO![]() 向____极移动。
向____极移动。
③当电路中转移0.1mol电子时,电解液质量(不含电极)增加了___克。
(3)已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka=3.0×10-8 |
①物质的量浓度均为0.1molL-1的四种溶液:pH由小到大排列的顺序是__(用编号填写)
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
②常温下,0.1molL-1CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是___(填字母)
A.c(H+) B.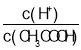 C.c(H+)c(OH-) D.
C.c(H+)c(OH-) D.![]() E.
E.![]()
③写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:____。
④25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO-)-c(Na+)=____(填准确数值)。
⑤标准状况下,将1.12LCO2通入100mL1molL-1的NaOH溶液中,用溶液中微粒的浓度符号完成下列等式:c(OH-)=2c(H2CO3)+____。




