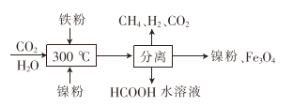
题目内容
【题目】铁及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)如图是自来水表的常见安装方式,发生腐蚀过程中,电流从_______ (填“接头流向水表”或“水表流向接头”)。

(2)某二次电池放电的电池反应为2Fe+O2+2H2O = 2Fe(OH)2。反应结束时,电极a的质量__________(填“减小”“不变”或“增加”),该电池的正极反应式为____________。

(3)有如图装置:

①图1中,用惰性电极电解过程中的实验数据如图,横坐标表示电解过程中转移电子的物质的量,纵坐标表示电解过程中图1装置中产生气体的总体积(标准状况)。电解过程中转移n(e-)=0.4mol,b电极的实验现象为_______________;Q点时,a电极收集到的气体体积为________________。

②图2中,装置通电后,溶液仍然保持澄清,铁电极附近呈紫红色(已知FeO42-在水溶液中呈紫红色),Fe电极上发生的电极反应式为___________。
【答案】水表流向接头 增加 O2+4e- +2H2O =4OH- 先有红色物质析出,后有气泡产生 2.24L Fe-6e- +8OH- = FeO42- +4H2O
【解析】
(1)铁比铜活泼,所以在发生腐蚀过程中,铁做负极,铜做正极,所以电流由水表流向接头;
(2)电极a为铁,放电过程中铁被氧化生成Fe2+与氢氧根反应生成Fe(OH)2沉淀附着在a电极上,所以反应结束后电极a质量增加;电极a发生氧化反应为负极,则电极b发生还原反应为正极,该过程中氧气在正极得电子被还原,方程式为O2+4e- +2H2O =4OH-;
(3)①电解过程中,b与电源负极相连,为电解池的阴极;电解硫酸铜溶液时阴极先发生Cu2++2e-=Cu,铜离子完全反应后发生2H++2e-=H2↑,据图可知气体的体积不是线性变化,说明反应过程中有氢气生成,所以现象为先有红色物质析出,后有气泡产生;a电极与电源正极相连,为电解池阳极,始终发生4OH--4e-=2H2O+ O2↑,Q点转移电子为0.4mol,根据电极方程式可知生成0.1mol氧气,标准状况下体积为2.24L;
②装置通电后,溶液仍然保持澄清,铁电极附近呈紫红色,说明无Fe2+或Fe3+生成,铁元素被氧化为FeO42-,则根据电子守恒可知电解过程中,Fe极发生的电极反应为Fe-6e-+8OH-=FeO42-+4H2O。