题目内容
 A、B、C、D、E、F六种元素分属三个短周期,且原子序数依次增大,A的原子在周期表中半 径最小,A、D伺主族,可形成离子化合物DA;C、F同主族,可形成FC2,FC3两种分子B,D,E 三者的最高价氧化物对应的水化物两两之间均可反应生成可溶性盐和水,所得盐中均含C元 素.请填写下列空白:
A、B、C、D、E、F六种元素分属三个短周期,且原子序数依次增大,A的原子在周期表中半 径最小,A、D伺主族,可形成离子化合物DA;C、F同主族,可形成FC2,FC3两种分子B,D,E 三者的最高价氧化物对应的水化物两两之间均可反应生成可溶性盐和水,所得盐中均含C元 素.请填写下列空白:(1)C在元素周期表中的位置为
(2)F单质的燃烧热△H=-akJ/mol,写出表示F单质的燃烧热的热化学方程式
(3)E单质与D的最高价氧化物的水化物的溶液反应的离子方程式为
(4)A、B两元素可形成离子化合物BA5,其电子式为
(5)将0.4mol FC2和0.2mol C2放入容积为2L的_密闭容器中,在一定条件下发生 反应2FC2+C2?2FC3,当FC2百分含量不变时,得到0.2mol FC3气体,则此时反应的平衡常数K=
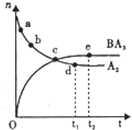
(6)向一绝热恒容密闭容器中通入B2和A2,在一定条件下发生反应B2(g)+3A2(g)?2BA3(g)△H<0,达到平衡,n(A2)和n(BA3)随时间变化的关系如图所示.下列有关叙述一定正确的是
A.c点表示BA3生成速率与BA3分解速率相等
B.c点和e点 A2的转化率相等
C.平衡后再升高温度,不利于BA3的合成
D.d点时:n(A2):n(BA3)=3:2
(7)将E元素的单质(除去氧化膜)投入浓的氯化铜溶液中,在其表面很 快出现一层红色物质,产生气体的速率逐渐加快,经检验,该气体为氢气,用温度计测得溶液的温度迅速升高.请从有关能量、是否有电化学作用等方面,分析能产生氢气且开始 阶段的速率不断加快的原因
分析:A、B、C、D、E、F六种元素分属三个短周期,且原子序数依次增大,A的原子在周期表中半径最小,则A为H元素;A、D同主族,可形成离子化合物DA,结合原子序数可知D为Na;C、F同主族,可形成FC2,FC3两种分子,可推知F为S元素、C为O元素;B、D、E 三者的最高价氧化物对应的水化物两两之间均可反应生成可溶性盐和水,所得盐中均含C元素,应是氢氧化铝与强酸、强碱的反应,结合原子序数,可推知B为N元素、E为Al,据此解答.
解答:解:A、B、C、D、E、F六种元素分属三个短周期,且原子序数依次增大,A的原子在周期表中半径最小,则A为H元素;A、D同主族,可形成离子化合物DA,结合原子序数可知D为Na;C、F同主族,可形成FC2,FC3两种分子,可推知F为S元素、C为O元素;B、D、E 三者的最高价氧化物对应的水化物两两之间均可反应生成可溶性盐和水,所得盐中均含C元素,应是氢氧化铝与强酸、强碱的反应,结合原子序数,可推知B为N元素、E为Al,
(1)由上述分析可知,C为O元素,处于在元素周期表中第二周期第ⅥA族,故答案为:第二周期第ⅥA族;
(2)S单质的燃烧热△H=-akJ/mol,则硫单质的燃烧热的热化学方程式为:S(s)+O2(g)=SO2(g)△H=-akJ/mol,
故答案为:S(s)+O2(g)=SO2(g)△H=-akJ/mol;
(3)D的最高价氧化物的水化物为NaOH,Al与氢氧化钠溶液反应生成偏铝酸钠与氢气,反应的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(4)H与N能形成离子化合物H5N,该物质为NH4H,其电子式为 ,故答案为:
,故答案为: ;
;
(5)将0.4mol SO2和0.2mol O2放入容积为2L的密闭容器中,在一定条件下发生反应,当SO2百分含量不变时,得到0.2mol SO3气体,则:
2SO2(g)+O2(g)?2SO3(g)
开始(mol):0.4 0.2 0
变化(mol):0.2 0.1 0.2
平衡(mol):0.2 0.1 0.2
则此时反应的平衡常数K=
=20,
故答案为:20;
(6)向一绝热恒容密闭容器中通入N2和H2,在一定条件下发生反应N2(g)+3H2(g)?2NH3(g)△H<0,达到平衡,n(H2)和n(NH3)随时间变化的关系如图所示,
A.c点以后n(NH3)增大,n(H2)减小,未到达平衡,反应向正反应进行,NH3生成速率小于分解速率,故A错误;
B.c点未到达平衡,反应向正反应进行,e点处于平衡状态,故e点H2的转化率较大,故B错误;
C.正反应为放热反应,平衡后再升高温度,平衡向逆反应方向移动,不利于NH3的合成,故C正确;
D.d点n(H2)和n(NH3)比例关系与起始物质的量及物质的转化率有关,n(H2):n(NH3)可能为3:2,可能不是3:2,故D错误,
故答案为:C;
(7)铝先置换出氯化铜中的铜,然后在金属表面形成无数微小的原电池,负极发生的反应:Al-3e-=Al3+,正极发生的反应:Cu2++2e-=Cu、2H++2e-=H2↑,所以溶液中有气体产生;由于该反应是放热反应,因此溶液温度迅速升高,产生氢气的速率不断加快,
故答案为:铝先置换出氯化铜中的铜,然后在金属表面形成无数微小的原电池,负极发生的反应:Al-3e-=Al3+,正极发生的反应:Cu2++2e-=Cu、2H++2e-=H2↑,所以溶液中有气体产生,又由于该反应是放热反应,因此溶液温度迅速升高,产生氢气的速率不断加快.
(1)由上述分析可知,C为O元素,处于在元素周期表中第二周期第ⅥA族,故答案为:第二周期第ⅥA族;
(2)S单质的燃烧热△H=-akJ/mol,则硫单质的燃烧热的热化学方程式为:S(s)+O2(g)=SO2(g)△H=-akJ/mol,
故答案为:S(s)+O2(g)=SO2(g)△H=-akJ/mol;
(3)D的最高价氧化物的水化物为NaOH,Al与氢氧化钠溶液反应生成偏铝酸钠与氢气,反应的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(4)H与N能形成离子化合物H5N,该物质为NH4H,其电子式为
 ,故答案为:
,故答案为: ;
;(5)将0.4mol SO2和0.2mol O2放入容积为2L的密闭容器中,在一定条件下发生反应,当SO2百分含量不变时,得到0.2mol SO3气体,则:
2SO2(g)+O2(g)?2SO3(g)
开始(mol):0.4 0.2 0
变化(mol):0.2 0.1 0.2
平衡(mol):0.2 0.1 0.2
则此时反应的平衡常数K=
(
| ||||
(
|
故答案为:20;
(6)向一绝热恒容密闭容器中通入N2和H2,在一定条件下发生反应N2(g)+3H2(g)?2NH3(g)△H<0,达到平衡,n(H2)和n(NH3)随时间变化的关系如图所示,
A.c点以后n(NH3)增大,n(H2)减小,未到达平衡,反应向正反应进行,NH3生成速率小于分解速率,故A错误;
B.c点未到达平衡,反应向正反应进行,e点处于平衡状态,故e点H2的转化率较大,故B错误;
C.正反应为放热反应,平衡后再升高温度,平衡向逆反应方向移动,不利于NH3的合成,故C正确;
D.d点n(H2)和n(NH3)比例关系与起始物质的量及物质的转化率有关,n(H2):n(NH3)可能为3:2,可能不是3:2,故D错误,
故答案为:C;
(7)铝先置换出氯化铜中的铜,然后在金属表面形成无数微小的原电池,负极发生的反应:Al-3e-=Al3+,正极发生的反应:Cu2++2e-=Cu、2H++2e-=H2↑,所以溶液中有气体产生;由于该反应是放热反应,因此溶液温度迅速升高,产生氢气的速率不断加快,
故答案为:铝先置换出氯化铜中的铜,然后在金属表面形成无数微小的原电池,负极发生的反应:Al-3e-=Al3+,正极发生的反应:Cu2++2e-=Cu、2H++2e-=H2↑,所以溶液中有气体产生,又由于该反应是放热反应,因此溶液温度迅速升高,产生氢气的速率不断加快.
点评:本题考查结构性质位置关系应用,推断元素是解题关键,题目综合性较大,涉及热化学方程式、常用化学用语、平衡常数、化学平衡图象、化学反应速率影响因素、原电池等,侧重对学生分析问题与知识迁移运用能力考查,(7)为易错点、难点,需要学生具备扎实的基础,难度中等.

练习册系列答案
相关题目
 [化学/选修/物质结构与性质]A、B、C、D、E五种短周期元素,原子序数依次增大,各元素对应的单质均为固体.A、C、E三元素的原子核外均只有2个未成对电子.B、E元素的原子序数之和等于C、D元素的原子序数之和.
[化学/选修/物质结构与性质]A、B、C、D、E五种短周期元素,原子序数依次增大,各元素对应的单质均为固体.A、C、E三元素的原子核外均只有2个未成对电子.B、E元素的原子序数之和等于C、D元素的原子序数之和.