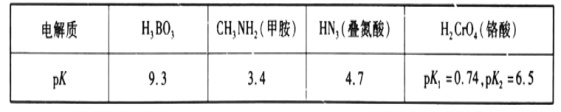
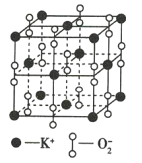
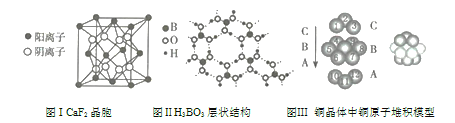
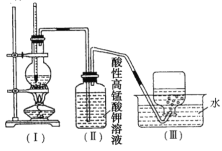
题目内容
【题目】下表中实线是元素周期表的部分边界,其中上边界并未用实线标出。
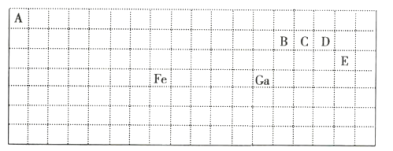
根据信息回答下列问题:
(1)基态Ga原子的最外层电子排布式为__。
(2)Fe元素位于周期表的__区;Fe与CO易形成配合物Fe(CO)5,在Fe(CO)5中铁的化合价为__。与CO分子互为等电子体的分子为__(填化学式)。
(3)在CH4、CO、CH3OH中,碳原子采取sp3杂化的分子有__。
(4)ED4-的价电子对互斥理论模型为__。B、C、D、E中两种原子相互结合形成的分子中,所有原子都满足最外层8电子稳定结构的是__(写2种,填化学式)。
【答案】4s24p1 d 0 N2 CH4、CH3OH 正四面体形 CO2、NCl3、CCl4(任写2种)
【解析】
(1)根据元素周期表的结构,Ga是第四周期第IIIA族的元素,据此分析解答;
(2)根据元素周期表五区的划分是根据最后排入的电子名称命名的,结合Fe原子是26号元素,Fe原子的基态核外电子排布式为:1s22s22p63s23p63d64s2;Fe与CO易形成配合物Fe(CO)5,根据化合物的化合价代数和为0,CO是化合物,它的化合价的代数和是0,据此计算Fe(CO)5中铁的化合价;根据等电子体的定义,只要原子数目和电子总数(或价电子总数)相同分析书写CO的等电子体;
(3)根据价层电子对数=σ键电子对数+中心原子上的孤电子对数计算判断;
(4)根据元素周期表知,A、B、C、D、E分别是H、C、N、O、Cl是五种元素,据此分析解答。
(1)元素周期表每一横行是一个周期,一共有18个纵行,从左向右,1、2和13至17七个纵行是主族,且第一纵行开始分别为第IA族、第IIA族,第十三综行开始为第IIIA族、第IVA族、第VA族、第IA族、第VIIA族,Ga是第四横行第13纵行的元素,所以Ga是第四周期第IIIA族的元素,主族元素的族序数=其最外层电子数,所以Ga最外层有3个电子,最外层电子排布式为4s24p1,故答案为:4s24p1;
(2)元素周期表五区的划分是根据最后排入的电子的轨道名称命名的,Fe原子是26号元素,Fe原子的基态核外电子排布式为:1s22s22p63s23p63d64s2,
这些电子排列时遵循能量最低原理(先排能量低的后排能量高的),这些能级的能量大小顺序为:1s<2s<2p<3s<3p<4s<3d,最后排入的是3d电子,属于d区元素;根据化合物化合价的代数和为0,Fe与CO易形成配合物Fe(CO)5中CO的化合价的代数和为0,则铁的化合价为0价;CO的等电子体必须是双原子分子或离子,且电子总数相等,分子可以是N2,离子可以是CN-,故答案为:d;0;N2(或CN-);
(3)CH4中C的价层电子对数=σ键+中心原子上的孤电子对数= 4+0=4,所以碳原子采取sp3杂化;CO分子中价层电子对数=σ键+中心原子上的孤电子对数= 1+1=2,所以碳原子采取sp杂化;CH3OH中C的价层电子对数=σ键+中心原子上的孤电子对数=4+0=4,所以碳原子采取sp3杂化,故答案为:CH4、CH3OH;
(4)根据元素周期表知,E是Cl元素,D是O元素,ED4-是ClO4-离子,价层电子对数=σ键+中心原子上的孤电子对数=4+![]() =4,根据VSEPR理论预测ED4-离子的空间构型为正四面体型;根据元素周期表知,B、C、D、E分别是C、N、O、Cl是四种元素,分子中每个原子最外层都达到8电子稳定结构的化合物有:CO2、CCl4、NCl3等,故答案为:正四面体;CO2、CCl4、NCl3。
=4,根据VSEPR理论预测ED4-离子的空间构型为正四面体型;根据元素周期表知,B、C、D、E分别是C、N、O、Cl是四种元素,分子中每个原子最外层都达到8电子稳定结构的化合物有:CO2、CCl4、NCl3等,故答案为:正四面体;CO2、CCl4、NCl3。

 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案【题目】某学习小组探究SO2与Cu(OH)2悬浊液的反应。
实验Ⅰ:向NaOH溶液中加入浓CuCl2溶液,制得含Cu(OH)2的悬浊液,测溶液pH≈13。向悬浊液中通入SO2,产生大量白色沉淀,测溶液pH≈3。推测白色沉淀中可能含有Cu+、Cu2+、Cl- 、SO42-、SO32-、HSO3-。
已知: i. Cu(NH3)42+(蓝色);Cu+![]() Cu(NH3)2+(无色);Cu+
Cu(NH3)2+(无色);Cu+![]() Cu+Cu2+
Cu+Cu2+
ii. Ag2SO4微溶于水,可溶于一定浓度的硝酸。
实验Ⅱ:

(1)①通过“白色沉淀A”确定一定存在的离子是____________________。
②判断白色沉淀中金属离子仅含有Cu+、不含Cu2+的实验证据是____________________。
③用以证实白色沉淀中无SO42-、SO32-、HSO3-的试剂a是____________________。
④生成CuCl的离子方程式是____________________。
(2)小组同学基于上述实验认为: SO2与Cu(OH)2悬浊液能发生氧化还原反应不仅基于本身的性质,还受到“生成了沉淀促进了氧化还原反应的发生”的影响。设计实验验证了此观点。
①用实验Ⅰ方法制得含Cu(OH)2的悬浊液,过滤、洗涤获取纯净的Cu(OH)2固体。检验Cu(OH)2固体是否洗涤干净的方法是____________________。
编号 | 实验 | 现象 |
III | 向Cu(OH)2固体中加入一定量的水,制得悬浊液(pH≈8),向悬浊液中通入SO2 | a. 底部产生少量浅黄色沉淀,慢慢消失 b. 静置,底部产生少量红色固体 |
IV | 向CuSO4溶液中通入SO2 | 无沉淀产生 |
②经确认浅黄色沉淀是CuOH,红色固体是Cu,证明SO2与Cu(OH)2悬浊液发生了氧化还原反应。最终生成Cu的原因是____________________。
③由实验III、IV可以得出的结论除“生成了沉淀促进了氧化还原反应的发生” 外还有____________________。
【题目】在20 L的密闭容器中按物质的量之比1∶2充入CO和H2,发生反应CO(g)+2H2(g)CH3OH(g) ΔH。测得CO的转化率随温度的变化及不同压强下CO的变化如图所示,p2和195 ℃时n(H2)随时间的变化结果如下表所示。下列说法正确的是( )
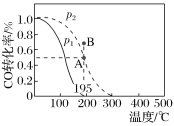
p2和195 ℃时n(H2)
t/min | 0 | 1 | 3 | 5 |
n(H2)/mol | 8 | 5 | 4 | 4 |
A.p2和195 ℃时,0~3 min,反应速率v(CH3OH)=![]() mol·L-1·min-1
mol·L-1·min-1
B.p1<p2,ΔH>0
C.195 ℃、p2时,在B点:v正>v逆
D.在p2和195 ℃时,该反应的平衡常数为25
【题目】下列实验方案能达到相应实验目的的是( )
选项 | 实验目的 | 实验方案 |
A | 检验溴乙烷中的溴原子 | 加入 |
B | 检验溴乙烷发生了消去反应 | 加 |
C | 除去溴苯中的溴 | 用 |
D | 确定乙醇分子的结构 | 通过质谱仪进行质谱分析 |
A.AB.BC.CD.D