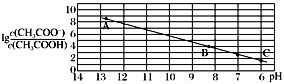
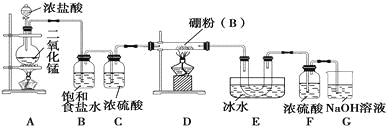
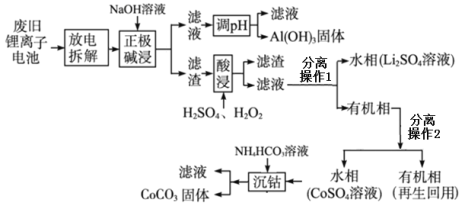
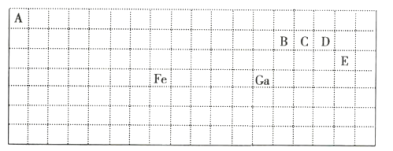
题目内容
【题目】常温下,100 mL 1.0 mol/L Na2C2O4 溶液中加入足量pH=1的稀硫酸,再加入20 mL KMnO4溶液恰好完全反应。下列说法正确的是( )
A.Na2C2O4溶液中C2O42-数目为0.1N A
B.稀硫酸中水电离的c(H+)=0.1 mol/L
C.KMnO4溶液浓度为0.1 mol/L
D.反应过程中转移电子数为0.2NA
【答案】D
【解析】
Na2C2O4 溶液中加入足量pH=1的稀硫酸,再加入KMnO4溶液反应的化学方程式为5Na2C2O4+2KMnO4+8H2SO4═l0CO2↑+2MnSO4+K2SO4+8H2O+5Na2SO4,据此分析解答。
A.100 mL 1.0 mol/L Na2C2O4 溶液中含有Na2C2O40.1L×1.0 mol/L=0.1mol,其中C2O42-水解,使得C2O42-数目少于0.1N A,故A错误;
B.稀硫酸为酸,抑制水的电离,pH=1的稀硫酸中水电离的c(H+)=![]() =10-13mol/L,故B错误;
=10-13mol/L,故B错误;
C.反应的方程式为5Na2C2O4+2KMnO4+8H2SO4═l0CO2↑+2MnSO4+K2SO4+8H2O+5Na2SO4,则KMnO4溶液中含有高锰酸钾的物质的量为![]() ×0.1mol=0.04mol,浓度为
×0.1mol=0.04mol,浓度为![]() =0.2 mol/L,故C错误;
=0.2 mol/L,故C错误;
D.反应的方程式为5Na2C2O4+2KMnO4+8H2SO4═l0CO2↑+2MnSO4+K2SO4+8H2O+5Na2SO4,反应中Mn由+7价降低为+2价,反应过程中转移电子0.04mol×(7-2)=0.2mol,数目为0.2NA,故D正确;
故选D。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目