题目内容
7.200mL密度为1.1g/cm3的某浓度的H2SO4,与9.75gZn恰好完全反应.计算:(1)生成多少升氢气(标准状况);
(2)H2SO4溶液的质量百分百浓度是多少?
分析 (1)发生反应Zn+H2SO4=ZnSO4+H2↑,根据n=$\frac{m}{M}$计算Zn的物质的量,根据方程式可知n(氢气)=n(Zn),再根据V=nVm计算氢气的体积;
(3)根据方程式计算H2SO4的物质的量,再根据m=nM计算H2SO4的质量,进而计算溶液质量分数.
解答 解:9.75gZn的物质的量为$\frac{9.75g}{65g/mol}$=0.15mol,
Zn+H2SO4=ZnSO4+H2↑
1 1 1
0.15mol 0.15mol 0.15mol
(1)标况下生成氢气为0.15mol×22.4L/mol/L=3.36L,
答:标况下,生成氢气体积为3.36L;
(2)H2SO4的质量为0.15mol×98g/mol=14.7g,H2SO4溶液的质量百分百浓度是$\frac{14.7g}{200mL×1.1g/mL}$×100%=6.68%,
答:H2SO4溶液的质量百分百浓度是6.68%.
点评 本题考查化学方程式计算,比较基础,注意对基础知识的理解掌握.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
15.下列说法正确的是( )
| A. | 在 101kPa 下,1克物质燃烧所放出的热量叫做该物质的热值 | |
| B. | 金属的防腐处理中,牺牲阳极的阴极保护法是电解池原理的应用 | |
| C. | 活化分子间的碰撞就是有效碰撞 | |
| D. | 催化剂能增大单位体积内活化分子百分数,从而增大反应速率 |
2.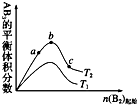 在其他条件不变时,改变某一条件对 A2(g)+3B2(g)?2AB3(g)化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度),由此可得出的结论是( )
在其他条件不变时,改变某一条件对 A2(g)+3B2(g)?2AB3(g)化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度),由此可得出的结论是( )
 在其他条件不变时,改变某一条件对 A2(g)+3B2(g)?2AB3(g)化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度),由此可得出的结论是( )
在其他条件不变时,改变某一条件对 A2(g)+3B2(g)?2AB3(g)化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度),由此可得出的结论是( )| A. | T1<T2,平衡常数 K1<K2 | |
| B. | 达到平衡时 A2 的转化率大小为 b>a>c | |
| C. | a、b、c 三点的平衡常数 Kb>Ka>Kc | |
| D. | 达到平衡时,AB3 的物质的量大小为 c>b>a |
12.高中化学学习过程中的物质颜色是需要注意的.下列关于颜色的描述正确的个数是( )
①氯水放久了会逐渐由黄绿色变成几乎无色
②AgBr见光分解会生成银白色的银
③KI溶液中加入淀粉溶液会变成紫色
④碘水中加入CCl4振荡静置后,下层紫红色
⑤钠在氯气中燃烧火焰为黄色.
①氯水放久了会逐渐由黄绿色变成几乎无色
②AgBr见光分解会生成银白色的银
③KI溶液中加入淀粉溶液会变成紫色
④碘水中加入CCl4振荡静置后,下层紫红色
⑤钠在氯气中燃烧火焰为黄色.
| A. | 1个 | B. | 2个 | C. | 3个 | D. | 4个 |
19.某溶液中只有Na+、CH3COO-、H+、OH-四种离子,且浓度大小的顺序为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-),该溶液可能是( )
| A. | 由0.1mol•L-1的CH3COOH溶液与0.1 mol•L-1的NaOH溶液等体积混合而成 | |
| B. | 由10mLpH=3的CH3COOH溶液与1 mL pH=11的NaOH溶液混合而成 | |
| C. | 由0.1mol•L-1的CH3COONa溶液与0.1 mol•L-1的NaOH溶液等体积混合而成 | |
| D. | 由0.1mol•L-1的CH3COONa溶液与0.1 mol•L-1的CH3COOH溶液等体积混合而成 |
16.NA表示阿伏加德罗常数,下列说法中正确的是( )
| A. | 常温常压下,48gO2跟48gO3 含有的氧原子数均为3NA | |
| B. | 1L 0.5mol/L的(NH4)2SO4溶液中含有NH4+数目为NA | |
| C. | 标准状况下,11.2L 氨气所含有的原子数是4NA | |
| D. | 80gNaOH溶解在1 L水中,得到溶液的物质的量浓度为2mol/L |
17.下列说法正确的是( )
| A. | 含金属元素的离子不一定是阳离子 | |
| B. | 金属单质跟酸反应,一定放出氢气 | |
| C. | 元素从化合态变为游离态时,一定被氧化 | |
| D. | 元素从化合态变为游离态时,一定被还原 |