��Ŀ����
����Ŀ�����ȱ���ȩ������ũҩ��ҽҩ���л��ϳɵ��м��壬����Ҫ���л�������Ʒ��ʵ������ȡ���ȱ���ȩ�Ĺ������¡�
��Cl2���Ʊ�
���շ��������ķ�����������ʵ�����Ʊ���������ʵ�������ø÷����Ʊ�Cl2��
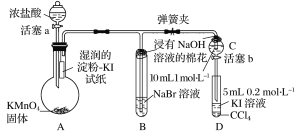
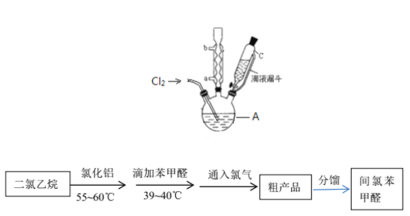
��1���÷�������ѡ��ͼ�е�_____������ĸ��ţ�ΪCl2����װ�ã���Ӧ���������ͻ�ԭ�������ʵ���֮��Ϊ_______��
��2��ѡ��ͼ�е�װ���ռ�һƿ���������Cl2���ӿڵ�����˳��Ϊa��___________��������������Сд��ĸ��ţ�
��3������ƽ���ƶ�ԭ�������ñ���ʳ��ˮ��ȥCl2�л��е�HCl��ԭ��_____________________��
���ȱ���ȩ���Ʊ�
��Ӧԭ����
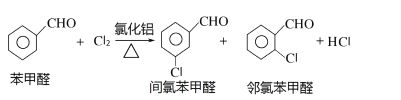
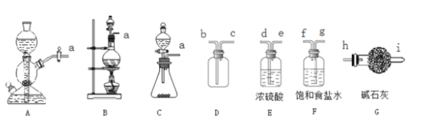
ʵ��װ�ú�������ͼ��ʾ��
��4��ͼ������A��������_____________��
��5�����ȱ���ȩ���Ʊ������У����������������________________________����ʵ��Ҫ����ˮ������������____________________________________________����ʵ�������κ��¹��̣�Ϊ���Ʒ�Ӧ�¶�����A���ɲ���________���ȵķ�����
���𰸡�B 1:2 g,f��d,e��b,c��h Cl2����ˮ���������¿��淴Ӧ��![]() ���ڱ���ʳ��ˮ�У�c(Cl-)�ϴ�ʹƽ�����ƣ������ܽ�ȼ�С�����Ȼ������弫������ˮ������ ������ƿ ���ܼ�������Ӧ��ʹ�����ĽӴ������ʹ���ַ�Ӧ ��ֹ���Ȼ���ˮ�����ˮ��������ȩ ˮԡ
���ڱ���ʳ��ˮ�У�c(Cl-)�ϴ�ʹƽ�����ƣ������ܽ�ȼ�С�����Ȼ������弫������ˮ������ ������ƿ ���ܼ�������Ӧ��ʹ�����ĽӴ������ʹ���ַ�Ӧ ��ֹ���Ȼ���ˮ�����ˮ��������ȩ ˮԡ
��������
ʵ�����Ʊ�����Ϊ�������̺�Ũ���ᷴӦ���������ȣ����շ������������ڼ��ȷ�Ӧ�����ռ����������У�Ҫ���ñ���ʳ��ˮ���ջӷ����Ȼ��⣬Ȼ����Ũ������������ſ������ռ���β���ü�ʯ�����ա�
��1��ʵ����Cl2���Ʊ�ѡ�ö������̺�Ũ������м��ȣ����ڹ�Һ������װ�ã��÷�������ѡ��ͼ�е�BΪCl2����װ�ã���Ӧ��������Ϊ�������̣���ԭ��Ϊ���ᣬ��ӦΪMnO2 + 4H+ + 2Cl- = Mn2+ + Cl2��+ 2H2O�����ʵ���֮��Ϊ1:2��
��2��ѡ��ͼ�е�װ���ռ�һƿ���������Cl2��Ũ���������ˮ�ԣ�����ʳ��ˮ���ջӷ������Ȼ�������ͽ����������ܽ�ȣ���ʯ�ҷ�ֹ����й©������β�����������ӿڵ�����˳��Ϊa��g,f��d,e��b,c��h��
��3���ñ���ʳ��ˮ��ȥCl2�л��е�HCl��ԭ��ΪCl2����ˮ���������¿��淴Ӧ��![]() ���ڱ���ʳ��ˮ�У�c(Cl-)�ϴ�ʹƽ�����ƣ������ܽ�ȼ�С�����Ȼ������弫������ˮ�����ա�
���ڱ���ʳ��ˮ�У�c(Cl-)�ϴ�ʹƽ�����ƣ������ܽ�ȼ�С�����Ȼ������弫������ˮ�����ա�
��4��ͼ������A��������������ƿ��
��5�����ȱ���ȩ���Ʊ������У�������������������ܼ�������Ӧ��ʹ�����ĽӴ������ʹ���ַ�Ӧ����ʵ��Ҫ����ˮ�����������Ƿ�ֹ���Ȼ���ˮ�����ˮ��������ȩ����ʵ�������κ��¹��̣�Ϊ���Ʒ�Ӧ�¶�����A���ɲ���ˮԡ���ȵķ�����

����Ŀ����ҵ���������Ҫ��ӦΪ4NH3(g)+5O2(g)4NO(g)+6H2O(l)��H
(1)��֪��������ȼ����Ϊ285.8kJmol-1
N2(g)+3H2(g)2NH3(g)��H=-92.4kJmol-1
N2(g)+O2(g)2NO(g)��H=+180.6kJmol-1
��������ҵ���������Ҫ��Ӧ����H=______��
(2)���ݻ��̶����ܱ������з���������Ӧ�������ڲ������ʵ����ʵ���Ũ�����±���
Ũ�� | c(NH3)(molL-1) | c(O2)(molL-1) | c(NO)(molL-1) |
��ʼ | 0.8 | 1.6 | 0 |
��2min | 0.6 | a | 0.2 |
��4min | 0.3 | 0.975 | 0.5 |
��6min | 0.3 | 0.975 | 0.5 |
��8min | 0.7 | 1.475 | 0.1 |
�ٷ�Ӧ�ڵ�2min����4min�ڣ�O2��ƽ����Ӧ����Ϊ______��
�ڷ�Ӧ�ڵ�6minʱ�ı����������ı������������______(�����)��
A ʹ�ô���������B �����¶�C ��СѹǿD ����O2��Ũ��
������˵������˵��4NH3(g)+5O2(g)4NO(g)+6H2O(g)�ﵽƽ��״̬����_____(�����)��
A ��λʱ��������nmolNO��ͬʱ������nmolNH3
B ����һ������������ƽ����Է����������ٱ仯
C �ٷֺ���w(NH3)=w(NO)
D ��Ӧ����v(NH3)��v(O2) ��v(NO) ��v(H2O)=4��5��4��6
E ���ں��º�ѹ���ݻ��ɱ�������з�Ӧ�����������ܶȲ��ٱ仯
(3)ij�о�����װ��CH3OH-O2ȼ�ϵ�صĹ���ԭ����ͼ��ʾ��
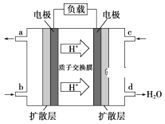
�ٸõ�ع���ʱ��b��ͨ�������Ϊ______��
�ڸõ�������ĵ缫��ӦʽΪ______��