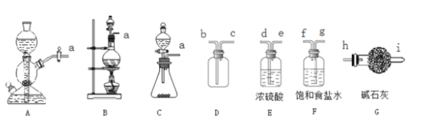
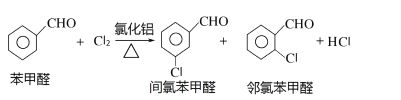
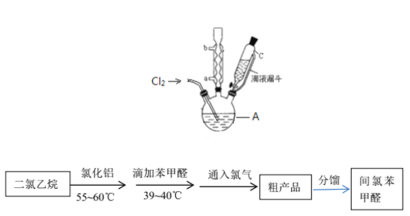
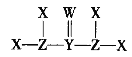题目内容
【题目】某新型可充电电池构造如图所示,工作时(需先引发Fe 和KClO3的反应,从而使 LiCl-KCl共晶盐熔化),某电极(记为X )的反应式之一为:xLi++ xe- +LiV3O8=Lii+xV3O8。下列说法正确的是

A.放电时,正极的电极反应式为: Li – e- = Li+
B.放电时,总反应式为:xLi + LiV3O8 = Lii+xV3O8
C.充电时,X电极与外接电源负极相连
D.充电时,X电极的质量增加
【答案】B
【解析】
A.放电时正极发生得电子的还原反应,即反应为:正极反应式为xLi++LiV3O8+xe-═Li1+xV3O8,故A错误;
B.放电时负极发生氧化反应,负极反应为xLi – xe- = xLi+(或Li – e- = Li+),则总反应式为xLi + LiV3O8 =Lii+xV3O8,故B正确;
C.X极为原电池的正极,充电时与外接电源的正极相连,故C错误;
D.充电时,X电极发生氧化反应,电极反应为Li1+xV3O8– xe- = xLi++LiV3O8,电极质量减轻,故D错误;
故答案为B。

练习册系列答案
相关题目