题目内容
【题目】氮硫的氧化物是造成大气污染的主要物质。研究它们的反应机理,对于消除环境污染有重要意义。
(1)2NO(g)+O2(g)=2NO2(g)△H的反应机理和各基元反应(基元反应是指在反应中一步直接转化为产物的反应,又称为简单反应)的活化能为:
2NO(g)![]() N2O2(g)E1=82kJ·mol-1v=k1c2(NO)
N2O2(g)E1=82kJ·mol-1v=k1c2(NO)
N2O2(g)![]() 2NO(g)E-1=205kJ·mol-1v=k-1c(N2O2)
2NO(g)E-1=205kJ·mol-1v=k-1c(N2O2)
N2O2(g)+O2(g)![]() 2NO2(g)E2=82kJ·mol-1v=k2c(N2O2)·c(O2)
2NO2(g)E2=82kJ·mol-1v=k2c(N2O2)·c(O2)
2NO2(g)![]() N2O2(g)+O2(g)E-2=72kJ·mol-1v=k-2c2(NO2)
N2O2(g)+O2(g)E-2=72kJ·mol-1v=k-2c2(NO2)
①2NO(g)+O2(g)![]() 2NO2(g)△H=______kJmol-1,平衡常数K与上述反应速率常数k1、k-1、k2、k-2的关系式为K=_______;
2NO2(g)△H=______kJmol-1,平衡常数K与上述反应速率常数k1、k-1、k2、k-2的关系式为K=_______;
②某温度下反应2NO(g)+O2(g)![]() 2NO2(g)的速率常数k=8.8×10-2L2mol-2s-1,当反应物浓度都是0.05molL-1时,反应的速率是__________________molL-1s-1;若此时缩小容器的体积,使气体压强增大为原来的2倍,则反应速率增大为之前的______倍。
2NO2(g)的速率常数k=8.8×10-2L2mol-2s-1,当反应物浓度都是0.05molL-1时,反应的速率是__________________molL-1s-1;若此时缩小容器的体积,使气体压强增大为原来的2倍,则反应速率增大为之前的______倍。
(2)2SO2(g)+O2(g)![]() 2SO3(g)反应过程中能量变化如图1所示。在V2O5存在时,该反应的机理为:V2O5+SO2
2SO3(g)反应过程中能量变化如图1所示。在V2O5存在时,该反应的机理为:V2O5+SO2![]() 2VO2+SO3(快)4VO2+O2
2VO2+SO3(快)4VO2+O2![]() 2V2O5(慢)
2V2O5(慢)
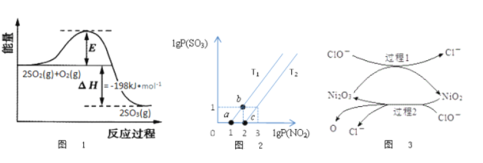
下列说法正确的是___________
A.反应速率主要取决于V2O5的质量
B.VO2是该反应的催化剂
C.逆反应的活化能大于198kJ/mol
D.增大SO2的浓度可显著提高反应速率
(3)某研究小组研究T1℃、T2℃时,氮硫的氧化物的转化:NO2(g)+SO2(g)![]() NO(g)+SO3(g)中lgP(NO2)和lgP(SO3)关系如图2所示,实验初始时体系中的P(NO2)和P(SO2)相等、P(NO)和P(SO3)相等。
NO(g)+SO3(g)中lgP(NO2)和lgP(SO3)关系如图2所示,实验初始时体系中的P(NO2)和P(SO2)相等、P(NO)和P(SO3)相等。
①根据题意可知:T1______T2(填“>”“<”或者“=”),理由是___________________。
②由平衡状态a到b,改变的条件是__________________。
(4)工业上可用NaClO碱性溶液或“亚硫酸盐法”吸收SO2。为了提高吸收效率,常用Ni2O3作为催化剂。催化过程如图3所示。
①过程2的离子方程式_______________________________。
②Ca(C1O)2也可用于脱硫,且脱硫效果比NaC1O更好,原因是________________。
【答案】-113 ![]() 1.1×10-5 8 CD < 该反应为放热反应,温度越高,Kp越小 将容器体积缩小为原来的0.1 2NiO2+ClO-=Ni2O3+Cl-+2O Ca2+和SO42-结合生成微溶的硫酸钙,有利于反应的进行
1.1×10-5 8 CD < 该反应为放热反应,温度越高,Kp越小 将容器体积缩小为原来的0.1 2NiO2+ClO-=Ni2O3+Cl-+2O Ca2+和SO42-结合生成微溶的硫酸钙,有利于反应的进行
【解析】
根据基元反应原理,总反应可分为几步简单反应,可逆反应存在正反两方向的简单反应,寻找规律,速率常数k等于反应物的浓度的反应系数指数幂乘积,据此回答问题。
(1)①根据基元反应含义,第1、3反应为正方向的2个基元反应,第2、4为逆方向的2个基元反应,2NO(g)+O2(g)![]() 2NO2(g)△H=E2+E1-E-1-E-1=-113kJmol-1,平衡常数K=
2NO2(g)△H=E2+E1-E-1-E-1=-113kJmol-1,平衡常数K=![]() ,反应到达平衡时,v正=v逆,所以k1c2(NO)= k-1c(N2O2),k2c(N2O2)·c(O2)= k-2c2(NO2),则有
,反应到达平衡时,v正=v逆,所以k1c2(NO)= k-1c(N2O2),k2c(N2O2)·c(O2)= k-2c2(NO2),则有![]() ;
;
②某温度下反应2NO(g)+O2(g)![]() 2NO2(g)的速率常数k=8.8×10-2L2mol-2s-1,当反应物浓度都是0.05molL-1时,反应的速率为
2NO2(g)的速率常数k=8.8×10-2L2mol-2s-1,当反应物浓度都是0.05molL-1时,反应的速率为![]() molL-1s-1;若此时缩小容器的体积,使气体压强增大为原来的2倍,浓度增大为原来的2倍,则反应速率增大为之前的23=8倍。
molL-1s-1;若此时缩小容器的体积,使气体压强增大为原来的2倍,浓度增大为原来的2倍,则反应速率增大为之前的23=8倍。
(2)A.V2O5的质量不影响反应速率,反应速率取决于慢反应速率,A错误;
B.VO2是该反应的中间态,并非催化剂,催化剂为V2O5,B错误;
C.生成物总能量低,逆反应的活化能大于198kJ/mol,C正确;
D.根据有效碰撞理论,增大SO2的浓度可显著提高反应速率,D正确;
答案为CD。
(3)①根据题意可知:T1<T2,理由是该反应为放热反应,温度越高,Kp越小。
②根据坐标可知,由平衡状态a到b,改变的条件是将容器体积缩小为原来的0.1。
(4)工业上可用NaClO碱性溶液或“亚硫酸盐法”吸收SO2。为了提高吸收效率,常用Ni2O3作为催化剂。
①从箭头指向可知,过程2的离子方程式2NiO2+ClO-=Ni2O3+Cl-+2O。
②Ca(C1O)2也可用于脱硫,且脱硫效果比NaC1O更好,原因是Ca2+和SO42-结合生成微溶的硫酸钙,有利于反应的进行。

 阅读快车系列答案
阅读快车系列答案