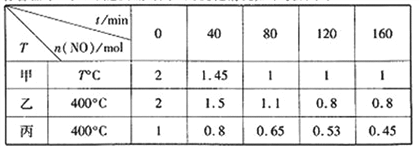
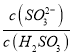题目内容
【题目】铜及其化合物应用广泛。
Ⅰ.氯化亚铜(CuCl)广泛用于化工、印染、有机合成等行业。以海绵铜(主要成分是Cu和少量CuO)为原料,采用硝酸铵氧化分解技术生产氯化亚铜的工艺过程如下:

已知:CuCl难溶于醇和水,可溶于氯离子浓度较大的体系,在潮湿空气中易氧化。
回答下列问题:
(1)步骤①中N元素被还原为最低价,则Cu溶解的离子方程式为________。
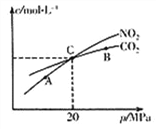
(2)步骤③中 (NH4)2SO3要适当过量,目的是使Cu2+充分还原速率和________,其主要反应的离子方程式为_________。已知NH4Cl、Cu2+的物质的量之比[n( NH4Cl )/n(Cu2+)]与Cu2+沉淀率的关系如右图所示,当氯化铵用量增加到一定程度后Cu2+的沉淀率减少,原因是________。

Ⅱ.以氧缺位铁酸铜(CuFe2O4-x)作催化剂,可利用太阳能热化学循环法分解H2O制H2,其物质转化如图甲所示。

①氧缺位铁酸铜(CuFe2O4-x)与水反应的化学方程式为________。
②若x=0.15,则1 mol CuFe2O4参与该循环过程理论上一次能制得标准状况下的H2体积为________L。(标准状况下)
③CuFe2O4可用电化学方法得到,其原理如图乙所示,则阳极的电极反应式为__________。
【答案】 4Cu+NO3- +10H+ = 4Cu2+ + NH4++3H2O 防止CuCl被空气氧化 2Cu2+ + SO32- + 2Cl-+ H2O = 2CuCl↓+ SO42-+ 2H+ 生成的氯化亚铜又溶解于氯化铵溶液中 CuFe2O4-x+xH2O= CuFe2O4+xH2 3.36 Cu+2Fe+4O2—8e-=CuFe2O4
【解析】Ⅰ.(1)步骤①中N元素被还原为最低价即-3价,则Cu溶解的离子方程式为4Cu+NO3- +10H+ = 4Cu2+ + NH4++3H2O;化学方程式为4Cu+NH4NO3 +5H2SO4= 4CuSO4 + (NH4)2SO4+3H2O;(2)步骤③中 (NH4)2SO3要适当过量,目的是保证使Cu2+充分还原的速率;防止CuCl被空气氧化;主要反应是铜离子与亚硫酸铵发生氧化还原反应生成CuCl,其离子方程式为2Cu2+ + SO32- + 2Cl-+ H2O = 2CuCl↓+ SO42-+ 2H+;当氯化铵用量增加到一定程度后Cu2+的沉淀率减少,原因是生成的氯化亚铜又溶解于氯化铵溶液中。
Ⅱ. ①根据图中信息可知,氧缺位铁酸铜(CuFe2O4-x)与水反应生成CuFe2O4和氢气,其化学方程式为:CuFe2O4-x+xH2O= CuFe2O4+xH2;②根据化学方程式CuFe2O4-x+xH2O= CuFe2O4+xH2,若x=0.15,则1 mol CuFe2O4参与该循环过程理论上一次能制得标准状况下的H2体积为0.15mol×22.4L/mol=3.36L;③根据电化学方法制得CuFe2O4的原理图可知,阳极铜铁合金熔融状态下失去电子与氧离子反应,电极反应式为:Cu+2Fe+4O2- -8e-=CuFe2O4。