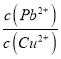题目内容
【题目】某原电池装置如图所示。

(1)其负极是_________(填“Zn”或“Cu”),发生的是__________(填“氧化”或“还原”)反应。
(2)正极上的现象是________________________________________。
(3)电子由_______________(填“锌片”或“铜片”)沿导线流出。
(4)电池的总反应是_______________________________________。
【答案】 Zn 氧化 有无色气泡产生 锌片 Zn + H2SO4== ZnSO4 + H2↑
【解析】(1)如图Cu-Zn-稀硫酸原电池,电解质溶液为稀硫酸,Zn为负极,Cu为正极,负极失电子发生氧化反应。(2)正极反应为:2H++2e-=H2↑,故在正极上有气体生成。(3)负极失电子,则电子由锌片沿导线流出。(4)Cu-Zn-稀硫酸原电池反应原理为锌与稀硫酸反应,方程式为Zn + H2SO4= ZnSO4 + H2↑。

 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
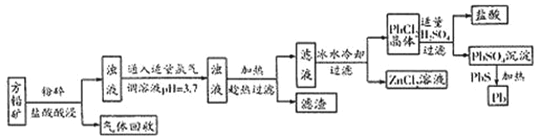
同步奥数系列答案【题目】硫酸镁晶体(MgSO4·7H2O)是一种重要的化工原料。以菱镁矿(主要成分是MgCO3,含少量FeCO3和不溶性杂质)为原料制取硫酸镁晶体的流程如下:
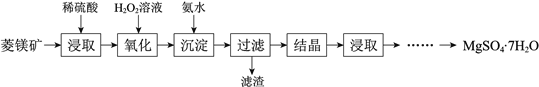
(1)MgCO3溶于稀硫酸的离子方程式是_________________________。
(2)加入H2O2溶液的目的是____________________(用离子方程式表示)。
(3)已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
阳离子 | Mg2+ | Fe2+ | Fe3+ |
开始沉淀 | 9.1 | 7.6 | 1.9 |
完全沉淀 | 11.1 | 9.7 | 3.2 |
“沉淀”步骤中,用氨水调节溶液pH的范围是______________________________。
(4)“过滤”所得滤液中存在大量的阳离子有Mg2+、____________。
(5)“结晶”步骤中需蒸发浓缩滤液,使用的仪器有铁架台、酒精灯和_________________。