题目内容
【题目】消除氮氧化物、二氧化硫等物质造成的污染是目前研究的重要课题。
(1)工业上常用活性炭还原一氧化氮,其反应为:2NO(g)+C(s) ![]() N2(g)+CO2(g)。向容积均为1 L的甲、乙、丙三个恒容恒温容器中分别加入足量的活性炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
N2(g)+CO2(g)。向容积均为1 L的甲、乙、丙三个恒容恒温容器中分别加入足量的活性炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
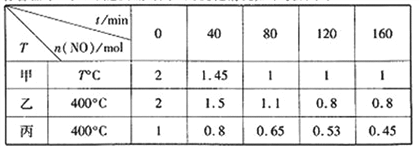
甲容器反应温度T℃______400℃(填“>”“<”或“=”);乙容器中,0~40min内平均反应速率v(CO2)=_____;丙容器中达平衡后NO的物质的量为_________mol。
(2)活性炭还原NO2的反应为:2NO2(g)+2C(s) ![]() N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量活性炭发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如右上图所示:
N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量活性炭发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如右上图所示:
①A、B、C三点中NO2的转化率最高的是_________点(填“A”或“B”或“C”)。
②计算C点时该反应的压强平衡常数KP=_______MPa
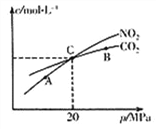 (Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)燃煤烟气脱硫常用如下方法。
方法①:用生物质热解气(主要成分CO、CH4、H2)将SO2在高温下还原成单质硫。涉及的部分反应如下:
2CO(g)+SO2(g)=S(g)+2CO2(g) △H1=8.0 kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H2=-566.0kJ·mol-1
2H2(g)+O2(g)=2H2O(g) △H3=-483.6 1kJ·mol-1
则H2(g)还原SO2(g)生成S(g)和H2O(g)的热化学方程式为_______________________。
方法②:用氨水将SO2转化为NH4HSO3,再氧化成(NH4)2SO4。
实验测得NH4HSO3溶液中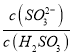 =15,则溶液的pH为________;向该溶液中加氨水使溶液呈中性时,
=15,则溶液的pH为________;向该溶液中加氨水使溶液呈中性时, 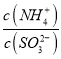 =________。(已知:H2SO3的Ka1=1.5×10-2,Ka2=1.0×10-7)
=________。(已知:H2SO3的Ka1=1.5×10-2,Ka2=1.0×10-7)
【答案】 > 6.25×10-3mol/(L·min) 0.4 A 4 2H2(g)+SO2(g)=S(g)+2H2O(g) △H=90.4kJ/mol 5 3
【解析】(1)甲达到平衡要80min,比乙达到平衡所需时间短,故T℃>400℃;乙容器中,0~40min内平均反应速率v(CO2)=v(NO)/2=![]() ;先根据乙求出400℃时的平衡常数
;先根据乙求出400℃时的平衡常数
2NO(g)+C(s) ![]() N2(g)+CO2(g)
N2(g)+CO2(g)
n始/mol 2
n变/mol 1.2 0.6 0.6
n平/mol 0.8 0.6 0.6
c平/mol/L 0.8 0.6 0.6
![]()
丙平衡时
2NO(g)+C(s) ![]() N2(g)+CO2(g)
N2(g)+CO2(g)
n始/mol 1
n变/mol 2x x x
n平/mol 1-2x x x
c平/mol/L 1-2x x x
 x=0.3mol,丙容器中达平衡后NO的物质的量为(1-0.3×2)mol=0.4mol;
x=0.3mol,丙容器中达平衡后NO的物质的量为(1-0.3×2)mol=0.4mol;
(2)①由方程式可知随压强的增大,平衡逆向移动,故A、B、C三点中NO2的转化率最高的是A点,A点压强最低;②C点时
2NO2(g)+2C(s) ![]() N2(g)+2CO2(g),
N2(g)+2CO2(g),
n始/mol 1
n变/mol 2x x 2x
n平/mol 1-2x x 2x
P平/MP 20×2/5 20×1/5 20×2/5
1-2x=2x,x=0.25
该反应的压强平衡常数KP= MPa;
MPa;
(3)由2CO(g)+SO2(g)=S(g)+2CO2(g) △H1=8.0 kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H2=-566.0kJ·mol-1
2H2(g)+O2(g)=2H2O(g) △H3=-483.6 1kJ·mol-1
得 △H3+△H1-△H2=-483.6 1kJ·mol-1+8.0 kJ·mol-1-566.0kJ·mol-1=90.4kJ/mol ,故则H2(g)还原SO2(g)生成S(g)和H2O(g)的热化学方程式为2H2(g)+SO2(g)=S(g)+2H2O(g) △H=90.4kJ/mol ;Ka1×Ka2=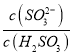 c(H+)2=1.5×10-2×1.0×10-7,c(H+)=10-5mol/L;则溶液的PH=5;NH4HSO3电荷守恒,c(NH4+ )+c(H+)=2c(SO32―)+c(HSO3-)+c(OH-),溶液呈中性,c(H+)=c(OH-),两边同除以(SO32―),
c(H+)2=1.5×10-2×1.0×10-7,c(H+)=10-5mol/L;则溶液的PH=5;NH4HSO3电荷守恒,c(NH4+ )+c(H+)=2c(SO32―)+c(HSO3-)+c(OH-),溶液呈中性,c(H+)=c(OH-),两边同除以(SO32―),  =2+
=2+ =2+c(H+)/ka2=3。
=2+c(H+)/ka2=3。

【题目】硫酸镁晶体(MgSO4·7H2O)是一种重要的化工原料。以菱镁矿(主要成分是MgCO3,含少量FeCO3和不溶性杂质)为原料制取硫酸镁晶体的流程如下:

(1)MgCO3溶于稀硫酸的离子方程式是_________________________。
(2)加入H2O2溶液的目的是____________________(用离子方程式表示)。
(3)已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
阳离子 | Mg2+ | Fe2+ | Fe3+ |
开始沉淀 | 9.1 | 7.6 | 1.9 |
完全沉淀 | 11.1 | 9.7 | 3.2 |
“沉淀”步骤中,用氨水调节溶液pH的范围是______________________________。
(4)“过滤”所得滤液中存在大量的阳离子有Mg2+、____________。
(5)“结晶”步骤中需蒸发浓缩滤液,使用的仪器有铁架台、酒精灯和_________________。






