题目内容
【题目】氢氧燃料电池一种新型环保的发电装置,用氢氧化钾做电解质溶液。
(1)氢氧燃料电池的能量转化的主要形式是________________,
(2)正极反应式为____________________。总反应式为____________________。
(3)氢氧燃料电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。因此,大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
Ⅰ.2Li+H2![]() 2LiH Ⅱ.LiH+H2O===LiOH+H2↑
2LiH Ⅱ.LiH+H2O===LiOH+H2↑
①反应Ⅰ中的氧化剂是________,反应Ⅱ中的还原剂是________。
②已知LiH固体密度为0.8 g/cm3,用锂吸收224 L(标准状况)H2,生成的LiH体积与被吸收的H2体积比为________。
③由②生成的LiH与H2O作用,放出的H2用作电池燃料,若能量转化率为90%,则导线中通过电子的物质的量为________mol。
【答案】 化学能转化为电能 O2 + 2 H2O +4e- = 4 OH- 2H2+O2=2H2O H2 LiH 1:1120 36
【解析】氢氧燃料电池工作时,氢气失电子是还原剂,发生氧化反应;氧气得电子是氧化剂,发生还原反应.电解质溶液是KOH溶液(碱性电解质)(1)氢氧燃料电池的能量转化的主要形式是化学能转化为电能;(2)正极是O2 得到电子,即:O2 +4e - ═2O2- ,O2- 在碱性条件下不能单独存在,只能结合H2O生成OH - 即:2O2- +2H2O═4OH - ,因此,正极的电极反应式为:O2 +H2O+4e- ═4OH-;总反应式为:2H2+O2=2H2O;(3)①H2得电子,反应Ⅰ中的氧化剂是H2,反应Ⅱ中LiH失电子,的还原剂是LiH。②224LH2与锂反应生成的LiH有160g,LiH与H2的体积比为(160/0.8):224000=1:1120;
③224LH2是10mol,得到20molLiH,应该是16mol电子
LiH+H2O=LiOH+H2,20molLiH生成20molH2,能量转化率为90%,所以实际参与反应的H2有20*90%=18mol,1molH2在电池的电极反应中失去2mol电子,所以所有的H2在反应中一共转移了36mol电子,即导线中通过电子的物质的量为36mol

 阅读快车系列答案
阅读快车系列答案【题目】硫酸镁晶体(MgSO4·7H2O)是一种重要的化工原料。以菱镁矿(主要成分是MgCO3,含少量FeCO3和不溶性杂质)为原料制取硫酸镁晶体的流程如下:
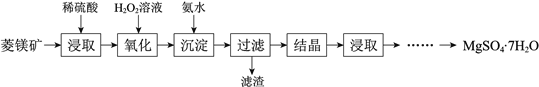
(1)MgCO3溶于稀硫酸的离子方程式是_________________________。
(2)加入H2O2溶液的目的是____________________(用离子方程式表示)。
(3)已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
阳离子 | Mg2+ | Fe2+ | Fe3+ |
开始沉淀 | 9.1 | 7.6 | 1.9 |
完全沉淀 | 11.1 | 9.7 | 3.2 |
“沉淀”步骤中,用氨水调节溶液pH的范围是______________________________。
(4)“过滤”所得滤液中存在大量的阳离子有Mg2+、____________。
(5)“结晶”步骤中需蒸发浓缩滤液,使用的仪器有铁架台、酒精灯和_________________。
【题目】铝热反应有广泛的用途,实验装置如图所示。
(1)铝热反应是 ________(填“吸热”或“放热”)反应,其能量变化可用下图中的_______(填序号)表示。
反应物的总能量高 | 生成物的总能量高 |
|
|
生成物的总能量低 | 反应物的总能量低 |
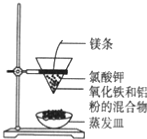
(2)该铝热反应的化学方程式是______________________________________________。
(3)任写出铝热反应在实际生产中的一种用途__________________________________。