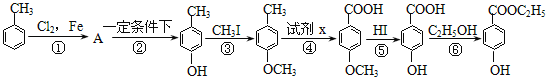
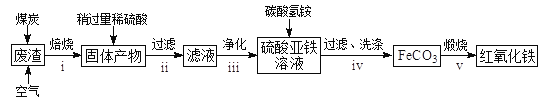
题目内容
【题目】Na2S可用于制造硫化染料、沉淀水体中的重金属等。
(1)Na2S溶液中S2-水解的离子方程式为_________。
(2)室温时,几种重金属离子的硫化物的溶度积常数如下表:
金属硫化物 | FeS | PbS | CuS | HgS |
Ksp | 6.3×10-18 | 1.0×10-28 | 6.3×10-36 | 1.6×10-52 |
①向物质的量浓度相同的Fe2+、Pb2+、Cu2+、Hg2+的混合稀溶液中,逐滴加入Na2S稀溶液,首先沉淀的离子是____。
②用Na2S溶液沉淀废水中Pb2+,为使Pb2+沉淀完全[c(Pb2+)≤1×10-6mol/L],则应满足溶液中c(S2-)≥_____mol/L。
③反应Cu2+(aq)+FeS(s)![]() Fe2+(aq)+CuS(s)的平衡常数K=_______。
Fe2+(aq)+CuS(s)的平衡常数K=_______。
(3)测定某Na2S和NaHS混合样品中两者含量的实验步骤如下:
步骤1.准确称取一定量样品于烧杯中,加入少量蒸馏水溶解,转移至500mL容量瓶中定容。
步骤2.准确移取25.00mL上述溶液于锥形瓶中,加入茜素黄GG-百时香酚蓝混合指示剂,用0.2500mol/L盐酸标准溶液滴定(Na2S+HCl=NaHS+NaCl)至终点,消耗盐酸24.00mL;向其中再加入5mL中性甲醛(NaHS+HCHO+H2O→NaOH+HSCH2OH)和3滴酚酞指示剂,继续用0.2500mol/L盐酸标准溶液滴定(NaOH+HCl=NaCl+H2O)至终点,又消耗盐酸34.00mL。
计算原混合物中Na2S与NaHS的物质的量之比(写出计算过程)___________。
【答案】S2-+H2O![]() HS-+OH- Hg2+ 1.0×10-22 1.0×1018 n(Na2S)=0.2500mol/L×24.00mL×10-3L/mL=6.000×10-3mol,n(NaHS)=0.2500mol/L×(34.00-24.00)×10-3L/mL=2.500×10-3mol,
HS-+OH- Hg2+ 1.0×10-22 1.0×1018 n(Na2S)=0.2500mol/L×24.00mL×10-3L/mL=6.000×10-3mol,n(NaHS)=0.2500mol/L×(34.00-24.00)×10-3L/mL=2.500×10-3mol,
n(Na2S)∶n(NaHS)=6.000×10-3mol∶2.500×10-3mol=12∶5
【解析】
(1)Na2S是强碱弱酸盐,由于H2S是二元弱酸,所以在溶液中S2-水解是分步进行的;
(2)①难溶性的物质构型相同时,溶度积常数越小,先形成其沉淀;
②溶液中c(Pb2+)·c(S2-)≥Ksp(PbS)时就形成PbS沉淀;
③根据平衡常数的定义式,将其变性,并与溶度积常数结合起来进行计算;
(3)根据Na2S+HCl=NaHS+NaCl计算n(Na2S);根据NaHS+HCHO+H2O→NaOH+HSCH2OH和NaOH+HCl=NaCl+H2O可知n(Na2S)与n(NaHS)的和,两者相减可得n(NaHS)的物质的量,进而可得两者物质的物质的量之比。
(1)Na2S是强碱弱酸盐,由于H2S是二元弱酸,所以在溶液中S2-水解是分步进行的,首先是S2-水解产生HS-,然后是水解产生的HS-进一步水解产生H2S,主要发生第一步水解反应,水解的离子方程式为:S2-+H2O![]() HS-+OH-;
HS-+OH-;
(2)①Fe2+、Pb2+、Cu2+、Hg2+都是+2价的金属阳离子,由于它们的浓度相同,因此向该溶液中加入Na2S溶液时,溶度积常数越小,形成沉淀越容易。根据重金属离子的硫化物的溶度积常数表可知HgS的最小,因此首先形成的是HgS沉淀;
②用Na2S溶液沉淀废水中Pb2+,使Pb2+沉淀完全,这时溶液中c(Pb2+)≤1×10-6mol/L,由于当c(Pb2+)·c(S2-)≥Ksp(PbS)时就可以形成PbS沉淀,所以c(S2-)≥1.0×10-28÷1.0×10-6=1.0×10-22mol/L;
③反应Cu2+(aq)+FeS(s)![]() Fe2+(aq)+CuS(s)的平衡常数K=
Fe2+(aq)+CuS(s)的平衡常数K=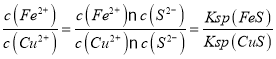 =1.0×1018;
=1.0×1018;
(3)根据发生反应Na2S+HCl=NaHS+NaCl消耗HCl可知:在25mL溶液中含有Na2S的物质的量为n(Na2S)= 0.2500mol/L×24.00mL×10-3L/mL=6.000×10-3mol,再根据NaHS+HCHO+H2O→NaOH+HSCH2OH及NaOH+HCl=NaCl+H2O反应消耗的HCl的体积可知25mL溶液中n(Na2S)与n(NaHS)的和为0.2500mol/L×34.00mL×10-3L/mL=8.500×10-3mol,则该溶液中含有NaHS的物质的量为n(NaHS)= 8.500×10-3mol-6.000×10-3mol=2.500×10-3mol,所以n(Na2S):n(NaHS)= 6.000×10-3mol:2.500×10-3mol=12∶5。溶液中溶质的物质的量的比与所取溶液体积无关,因此原溶液中n(Na2S):n(NaHS)= 12∶5。

 小学课时特训系列答案
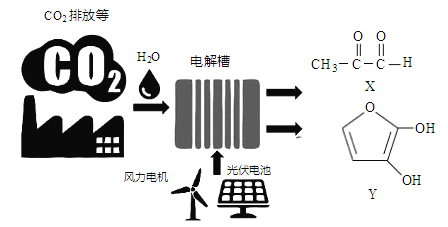
小学课时特训系列答案【题目】甲醇是一种可再生能源,具有广阔的开发和应用前景,可用![]() 等作为催化剂,采用如下反应来合成甲醇:
等作为催化剂,采用如下反应来合成甲醇:![]()
(1)下表是有关化学键的键能数据,计算表中的a=__________。
化学键 |
|
|
|
|
|
键能 | 436 | 462.8 | a | 1075 | 351 |
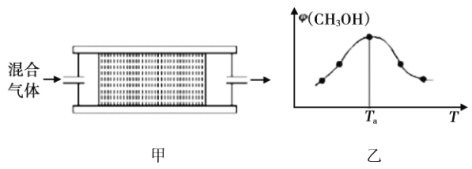
(2)将![]() 的混合气体,匀速通过装有催化剂的反应器反应(如图甲),反应器温度变化与从反应器排出气体中
的混合气体,匀速通过装有催化剂的反应器反应(如图甲),反应器温度变化与从反应器排出气体中![]() 的体积分数φ关系如图乙,φ(CH3OH)变化的原因是__________。
的体积分数φ关系如图乙,φ(CH3OH)变化的原因是__________。
(3)某学习小组模拟工业合成甲醇的反应,在![]() 的恒容密闭容器内充入
的恒容密闭容器内充入![]() 和
和![]() ,加入合适催化剂后在某温度下开始反应,并用压力计监测容器内压强的变化如表:
,加入合适催化剂后在某温度下开始反应,并用压力计监测容器内压强的变化如表:
反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 |
压强/MPa | 12.6 | 10.8 | 9.5 | 8.7 | 8.4 | 8.4 |
从反应开始到![]() 时,
时,![]() 的平均反应速率为______,该温度下的平衡常数
的平均反应速率为______,该温度下的平衡常数![]() 为______。
为______。
(4)另将![]() 和
和![]() 加入密闭容器中,在一定条件下发生上述反应。平衡时
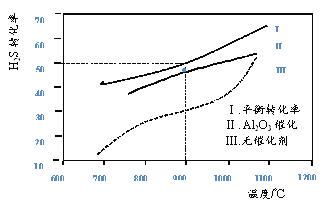
加入密闭容器中,在一定条件下发生上述反应。平衡时![]() 的体积分数(%)与温度和压强的关系如图所示(虚线框表示没有测定该条件下的数据)。
的体积分数(%)与温度和压强的关系如图所示(虚线框表示没有测定该条件下的数据)。
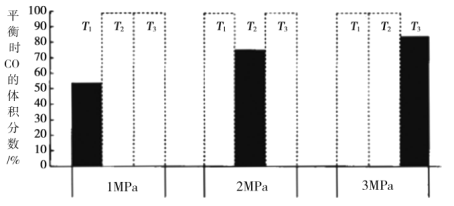
![]() 由大到小的关系是__________,判断理由是__________。
由大到小的关系是__________,判断理由是__________。
【题目】下列根据实验操作和现象所得出的结论正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 将SO2气体通入Ba(NO3)2溶液 | 有白色沉淀 | SO2中混有SO3 |
B | 向NaAlO2溶液中持续通入气体Y | 先出现白色沉淀,最终沉淀又溶解 | Y可能是CO2气体 |
C | AgCl悬浊液中滴入少量Na2S溶液 | 沉淀变黑色 | Ksp(Ag2S)>Ksp(AgCl) |
D | 向盛有KI3溶液的两试管中分别加入淀粉溶液和AgNO3溶液 | 前者溶液变蓝色,后者有黄色沉淀 | KI3溶液中存在平衡: I3- |
A. A B. B C. C D. D
【题目】Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物,羟基自由基的产生与溶液pH大小有关。现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响。
(实验过程)

用图所示装置进行如下表所示的实验,控制p-CP的初始浓度相同,其余实验条件见下表,设计如下对比实验,最终测量的是p-CP浓度的改变量。
(实验数据)
实验编号 | H2O2溶液 | Fe2+溶液 | 蒸馏水 | pH | 温度 | ||
c/(10-3mol·L-1) | V/mL | c/(10-3mol·L-1) | V/mL | V/mL | T/K | ||
① | 6.0 | 1.5 | 0.30 | 3.5 | 10 | 3 | 298 |
② | 6.0 | 1.5 | 0.30 | 3.5 | 10 | 3 | 313 |
③ | 6.0 | 3.5 | 0.30 | 3.5 | x | 3 | 298 |
④ | 6.0 | 1.5 | 0.30 | 4.5 | 9 | 3 | 298 |
⑤ | 6.0 | 1.5 | 0.30 | 3.5 | 10 | 10 | 298 |
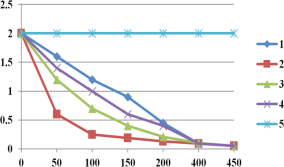
图2实验测得p-CP的浓度随时间的变化
(分析与解释)
(1)实验③中,x=________。
(2)实验①、⑤的目的是________。
(3)实验①、②表明温度升高,降解反应速率增大。但温度过高是反而导致降解反应速率减少,从Fenton法所用试剂H2O2性质的角度分析原因_____(请用化学用语解答)。
(4)通过实验⑤可以得出结论是是pH等于10时,降解反应趋于停止,推测可能的原因:__。