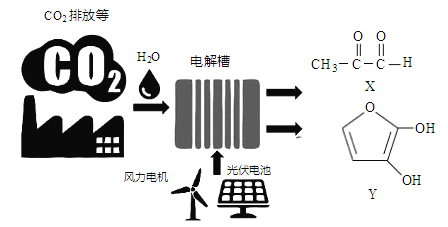
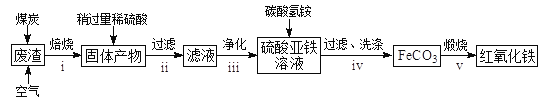
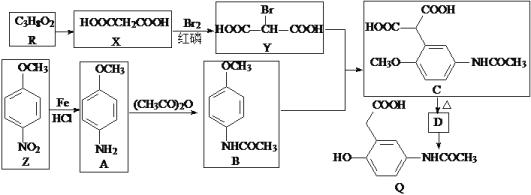
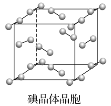
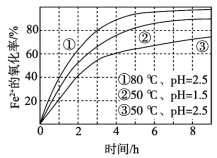
题目内容
【题目】如图是实验室制取SO2并验证SO2某些性质的装置图。若观察到装置④中的有淡黄色沉淀生成,⑤中的溴水褪色(已知因含有Br2而溴水呈红棕色),请回答:
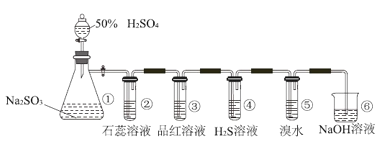
(1)①中发生反应的离子方程式为_____。
(2)③的实验现象是_____,证明SO2有_____性。
(3)④中SO2做_____剂。
(4)⑤中反应生成两种强酸,该反应的离子方程式是_____。
(5)⑥的作用是_____。
【答案】2H++SO32-=H2O+SO2↑ 品红溶液褪色 漂白 氧化 SO2+Br2+2H2O=2Br-+SO42-+4H+ 吸收未反应的SO2,防止污染空气
【解析】
硫酸和亚硫酸钠在①中发生反应生成硫酸钠和水和二氧化硫;二氧化硫在②中与水反应生成亚硫酸,亚硫酸是一种弱酸,使石蕊溶液变红;二氧化硫有漂白性,使③中品红溶液褪色;二氧化硫有氧化性,与H2S在④中反应生成S单质和H2O;SO2有还原性,在⑤中还原Br2使溴水褪色;SO2有毒,能和NaOH溶液反应,多余的SO2用NaOH溶液吸收,防止污染空气,据此解答。
(1)硫酸和亚硫酸钠在①中发生反应生成硫酸钠和水和二氧化硫,反应的离子方程式为:2H++SO32-=H2O+SO2↑,故答案为:2H++SO32-=H2O+SO2↑;
(2)SO2有漂白性,使③中品红溶液褪色,故答案为:品红溶液褪色;漂白;
(3)④中发生的反应为:2H2S+SO2=3S↓+2H2O,SO2中的S元素得电子,化合价降低,作氧化剂,故答案为:氧化;
(4)SO2有还原性,溴有强氧化性,二者在⑤中发生反应的离子方程式为:SO2+Br2+2H2O=2Br-+SO42-+4H+,故答案为:SO2+Br2+2H2O=2Br-+SO42-+4H+;
(5)未反应的SO2直接排放会污染空气,所以⑥的作用是吸收未反应的SO2,防止污染空气,故答案为:吸收未反应的SO2,防止污染空气。

【题目】下列根据实验操作和现象所得出的结论正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 将SO2气体通入Ba(NO3)2溶液 | 有白色沉淀 | SO2中混有SO3 |
B | 向NaAlO2溶液中持续通入气体Y | 先出现白色沉淀,最终沉淀又溶解 | Y可能是CO2气体 |
C | AgCl悬浊液中滴入少量Na2S溶液 | 沉淀变黑色 | Ksp(Ag2S)>Ksp(AgCl) |
D | 向盛有KI3溶液的两试管中分别加入淀粉溶液和AgNO3溶液 | 前者溶液变蓝色,后者有黄色沉淀 | KI3溶液中存在平衡: I3- |
A. A B. B C. C D. D
【题目】Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物,羟基自由基的产生与溶液pH大小有关。现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响。
(实验过程)

用图所示装置进行如下表所示的实验,控制p-CP的初始浓度相同,其余实验条件见下表,设计如下对比实验,最终测量的是p-CP浓度的改变量。
(实验数据)
实验编号 | H2O2溶液 | Fe2+溶液 | 蒸馏水 | pH | 温度 | ||
c/(10-3mol·L-1) | V/mL | c/(10-3mol·L-1) | V/mL | V/mL | T/K | ||
① | 6.0 | 1.5 | 0.30 | 3.5 | 10 | 3 | 298 |
② | 6.0 | 1.5 | 0.30 | 3.5 | 10 | 3 | 313 |
③ | 6.0 | 3.5 | 0.30 | 3.5 | x | 3 | 298 |
④ | 6.0 | 1.5 | 0.30 | 4.5 | 9 | 3 | 298 |
⑤ | 6.0 | 1.5 | 0.30 | 3.5 | 10 | 10 | 298 |
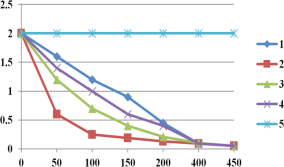
图2实验测得p-CP的浓度随时间的变化
(分析与解释)
(1)实验③中,x=________。
(2)实验①、⑤的目的是________。
(3)实验①、②表明温度升高,降解反应速率增大。但温度过高是反而导致降解反应速率减少,从Fenton法所用试剂H2O2性质的角度分析原因_____(请用化学用语解答)。
(4)通过实验⑤可以得出结论是是pH等于10时,降解反应趋于停止,推测可能的原因:__。