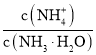题目内容
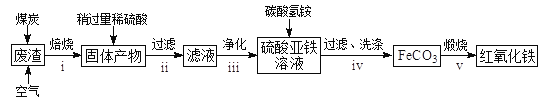
【题目】混合动力汽车(HEV)中使用了镍氢电池,其工作原理如图所示:其中M为储氢合金,![]() 为吸附了氢原子的储氢合金,
为吸附了氢原子的储氢合金,![]() 溶液作电解液。关于镍氢电池,下列说法正确的是( )
溶液作电解液。关于镍氢电池,下列说法正确的是( )
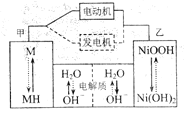
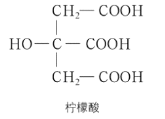
A.充电时,阴极附近![]() 降低
降低
B.发电机工作时溶液中![]() 向甲移动
向甲移动
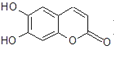
C.放电时正极反应式为:![]()
D.电极总反应式为:![]()
【答案】C
【解析】
放电过程为原电池,NiOOH转变为Ni(OH)2,镍元素化合价由+3价降到+2价,乙为正极,电极反应式为NiOOH+H2O+e-═Ni(OH)2+OH-,甲为负极,MH中氢元素化合价由0价升高到+1价,发生氧化反应与溶液中的氢氧根离子结合成水,电极反应为MH-e-+OH-═M+H2O;充电是放电的逆过程,此时甲为阴极,发生还原反应,乙为阳极,发生氧化反应。
A. 充电时,阴极发生还原反应,电极反应为M+H2O+e═MH+OH,生成氢氧根,pH增大,A错误;
B. 发电机工作时是充电过程,电解池原理,溶液中氢氧根离子向阳极移动,即乙电极迁移,B错误;
C. 正极得电子,发生还原反应,其电极反应式为NiOOH+H2O+e═Ni(OH)2+OH,C正确;
D. 放电过程的正极反应为:NiOOH+H2O+e═Ni(OH)2+OH,负极反应为:MH-e-+OH-═M+H2O,则电池总反应为:![]() ,D错误;故答案为:C。
,D错误;故答案为:C。

 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
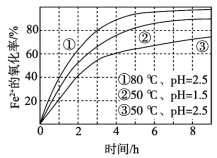
百分学生作业本题练王系列答案【题目】Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物,羟基自由基的产生与溶液pH大小有关。现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响。
(实验过程)

用图所示装置进行如下表所示的实验,控制p-CP的初始浓度相同,其余实验条件见下表,设计如下对比实验,最终测量的是p-CP浓度的改变量。
(实验数据)
实验编号 | H2O2溶液 | Fe2+溶液 | 蒸馏水 | pH | 温度 | ||
c/(10-3mol·L-1) | V/mL | c/(10-3mol·L-1) | V/mL | V/mL | T/K | ||
① | 6.0 | 1.5 | 0.30 | 3.5 | 10 | 3 | 298 |
② | 6.0 | 1.5 | 0.30 | 3.5 | 10 | 3 | 313 |
③ | 6.0 | 3.5 | 0.30 | 3.5 | x | 3 | 298 |
④ | 6.0 | 1.5 | 0.30 | 4.5 | 9 | 3 | 298 |
⑤ | 6.0 | 1.5 | 0.30 | 3.5 | 10 | 10 | 298 |
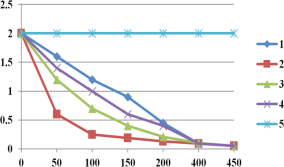
图2实验测得p-CP的浓度随时间的变化
(分析与解释)
(1)实验③中,x=________。
(2)实验①、⑤的目的是________。
(3)实验①、②表明温度升高,降解反应速率增大。但温度过高是反而导致降解反应速率减少,从Fenton法所用试剂H2O2性质的角度分析原因_____(请用化学用语解答)。
(4)通过实验⑤可以得出结论是是pH等于10时,降解反应趋于停止,推测可能的原因:__。