题目内容
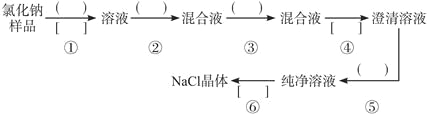
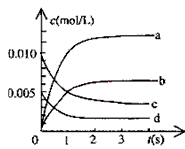
【题目】在1L含0.2molKOH、0.1molNaAlO2和0.1 mol Ba(NO3) 2 的混合溶液中,逐滴加入浓度为0.1 mol/L 的H 2 SO 4 溶液,下列图像中能表示反应产生的沉淀的物质的量和所加入硫酸溶液的体积关系是(已知AlO2-和Ba2+可以大量共存)

【答案】A
【解析】
试题分析:在1L含0.2molKOH、0.1molNaAlO2和0.1 mol Ba(NO3) 2 的混合溶液中,向该混合溶液中加入H2SO4溶液,首先发生反应Ba(OH)2+H2SO4=BaSO4↓+2H2O,Ba(OH)2反应完毕,继续加入H2SO4溶液,再发生反应AlO2-+H++H2O=Al(OH)3↓,AlO2-反应完毕,沉淀达最大,继续加入H2SO4溶液,发生反应Al(OH)3+3H+=Al3++3H2O,沉淀减少,Al(OH)3反应完毕,最后为BaSO4沉淀,继续加入H2SO4溶液,沉淀的量不变。第一阶段:由发生反应Ba(OH)2+H2SO4=BaSO4↓+2H2O可知,Ba(OH)2反应完毕,需加入0.1molH2SO4,H2SO4溶液的体积为0.1mol÷0.1L=1L,生成沉淀n(BaSO4)=0.1mol;第二阶段:由发生反应AlO2-+H++H2O=Al(OH)3↓可知,0.1molAlO2-反应完毕,该阶段需加入0.05molH2SO4,H2SO4溶液的体积为0.05mol÷0.1mol/L=0.5L,该阶段生成沉淀n[Al(OH)3]=0.1mol,但加入相同体积的硫酸,该阶段比第一阶段生成沉淀的多,为第一阶段的2倍;第三阶段:由发生反应Al(OH)3+3H+=Al3++3H2O可知,沉淀减少,0.1molAl(OH)3完全溶解,该阶段需加入(0.1mol8×3)÷2=0.15molH2SO4,H2SO4溶液的体积为0.15mol÷0.1L=1.5L,沉淀n(BaSO4)=0.1mol。由上述分析可知:第一阶段产生沉淀n(BaSO4)=0.1mol,加入H2SO4溶液的体积为1L;第二阶段又生成沉淀n[Al(OH)3]=0.1mol,此时沉淀总量为0.2mol,该阶段加入H2SO4溶液的体积为0.1L,此时加入H2SO4溶液的总体积为1.5L;第三阶段0.1molAl(OH)3完全溶解,此时沉淀n(BaSO4)=0.1mol,该阶段加入H2SO4溶液的体积为1.5L,此时加入H2SO4的总体积为3L,故沉淀的量与H2SO4溶液体积关系图为:
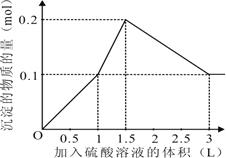 ,答案选A。
,答案选A。

 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
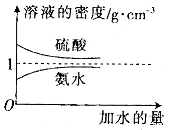
芒果教辅达标测试卷系列答案【题目】已知硫酸、氨水的密度与所加水量的关系如图所示,现有硫酸与氨水各一份,请根据表中的信息,回答下列问题 :
溶质的物质的量浓度/ | 溶液的密度/ |
| |
硫酸 |
|
| |
氨水 |
|
|
(1)表中硫酸的质量分数为__________(不写单位,用含![]() 、
、![]() 的代数式表示)。
的代数式表示)。
(2)物质的量浓度为![]()
![]() 的硫酸与水等体积混合(混合后溶液体积变化忽略不计),所得溶液的物质的量浓度为___________
的硫酸与水等体积混合(混合后溶液体积变化忽略不计),所得溶液的物质的量浓度为___________![]() 。
。
(3)物质的量浓度为![]()
![]() 的氨水与
的氨水与![]()
![]()
![]() 的氨水等质量混合,所得溶液的密度______(填
的氨水等质量混合,所得溶液的密度______(填
“大于”、“小于”或“等于”,下同) ![]()
![]() ,所得溶液的物质的量浓度________
,所得溶液的物质的量浓度________![]()
![]()
![]()
(设混合后溶液的体积变化忽略不计)
(4)若将稀硫酸与氨水混合,写出其反应的离子方程式___________________________.