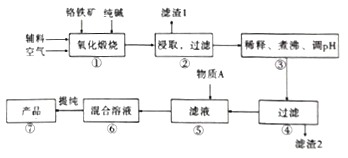
题目内容
【题目】固体硝酸盐加热易分解且产物较复杂,某学习小组以Fe(NO3)2为研究对象,通过实验探究其热分解的产物,查阅资料,根据硝酸盐受热分解的规律,提出如下4种猜想:
甲:Fe2O3、NO2乙:Fe2O3、NO2、O2丙:Fe3O4、NO2、O2丁:FeO、NO2、N2
(1).实验前,小组成员经讨论认定猜想丁不成立,理由是__________________.
针对上述猜想,设计如图所示的实验装置(图中加热、夹持仪器等均省略):
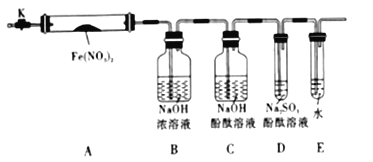
(2).实验过程
①仪器连接后,放人固体试剂之前,应______________
②称取Fe(NO3)2固体3.6g置于A中,加热前先打开K,___________,后再关闭K,用酒精灯加热
③观察到A中有红棕色气体出现,C、D中未见明显变化.
④待样品完全分解,A装置冷却至室温、称量,测得剩余固体的质量为1.6g
⑤取少量剩余固体于试管中,加人适量水,未见明显现象.
(3).实验结果分析讨论:
①根据实验现象和剩余固体的质量经分析,可初步确认分解产物中有____________。
②根据D中无明显现象,一位同学认为不能确认分解产物中有O2,因为若有O2,D中溶液颜色会退去;另一个同学认定分解产物中有O2存在,未检侧到的原因是_________________。
③为了验证是否有O2,某同学另称Fe(NO3)2固体3.6g,充分加热,收集气体,假设产生的气体全部收集,将集满气体的试管倒放在水槽中,观察到的现象是红棕色消失,液面上升,进入试管中的溶液大于2/3,通入一定量的O2后,气体全部被吸收,请写出Fe(NO3)2受热分解的化学方程式______________,通入O2的物质的量为_____________。
④小组讨论后达成的共识是上述实验设计仍不完善,需改进装置进一步研究。写一点不足之处:__________________________。
【答案】(1).不符合氧化还原反应原理(2分)
(2).①检验装置的气密性(1分)
②通入N2充满整个装置(2分)
(3)①Fe2O3、NO2(2分)②NO2和O2按4:1完全溶于溶液中(2分)
③4Fe(NO3)2![]() 2Fe2O3+8NO2↑+O2↑(2分) 0.005mol(2分)
2Fe2O3+8NO2↑+O2↑(2分) 0.005mol(2分)
④在A和B处加一个防倒吸的装置或者产生的气体不易收集(合理即给分)(2分)
【解析】
试题分析:(1)根据氧化还原反应原理有化合价的升高就有化合价的降低,而丁中只有化合价的降低,故不可能。
(2)该实验是通过定量和定性相结合的方法进行探究,通过固体质量的减少可以确定剩余的固体产物;通过红棕色气体,说明有NO2气体,排除丙的可能。①一个完整的实验流程:安装,检查气密性,装药,实验,拆装置……,该过程为检查气密性;②该实验过程中要排除氧气的干扰,故先用氮气排除空气,加热的操作时先预热,再对准一点加热。
(3)①红棕色气体是二氧化氮;硝酸亚铁的物质的量是0.02mol,全部转化为氧化铁是0.01mol,质量是1.6g,剩余的固体恰好是1.6g,则分解产物中有氧化铁和NO2;②由于NO2和O2按4:1完全溶于溶液中,所以没有检测到氧气;③将集满气体的试管倒放在水槽中,观察到的现象是红棕色消失,液面上升,进入试管中的溶液大于2/3,通入一定量的O2后,气体全部被吸收,这说明生成的NO2的体积大于4倍氧气的体积,因此Fe(NO3)2受热分解的化学方程式为4Fe(NO3)2![]() 2Fe2O3+8NO2↑+O2↑。生成NO2是0.04mol,完全溶解需要0.01mol氧气,而生成的氧气只有0.005,所以还需要再通入0.005mol氧气。
2Fe2O3+8NO2↑+O2↑。生成NO2是0.04mol,完全溶解需要0.01mol氧气,而生成的氧气只有0.005,所以还需要再通入0.005mol氧气。
④由于NO2溶于水容易产生倒吸现象,因此改进的措施是在A和B处加一个防倒吸的装置或者产生的气体不易收集。