题目内容
【题目】氯化钠样品中含有少量的杂质Na2SO4,按下列流程进行净化,请在流程中的( )中写上合适的试剂,在[ ]中写上实验操作名称。写出有关反应的化学方程式:
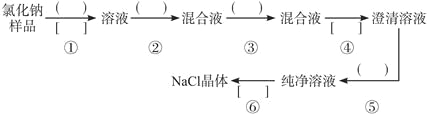
(1)操作①、②、③、⑤中所需加入试剂分别为________、_________、_________、________。
(2)操作①、④、⑥的操作名称分别为_________、_________、_________。
(3)写出有关的化学方程式:
第②步:_____________________________。
第⑤步:_____________________________。
(4)操作④所用到的玻璃仪器有_____________。
【答案】①蒸馏水;溶解
②BaCl2溶液
③Na2CO3溶液
④过滤
⑤稀盐酸
⑥蒸发结晶
②Na2SO4+BaCl2=BaSO4↓+2NaCl
⑤Na2CO3+2HCl=2NaCl+H20+C02↑ 烧杯、漏斗、玻璃棒等
【解析】试题分析:因为要除去氯化钠晶体中含有少量的Na2SO4杂质,实质就是除去硫酸根,①根据实验流程,首先要溶于水配制成溶液,溶液中含有硫酸钠和氯化钠两种物质,故①中加入的试剂为蒸馏水,操作名称为溶解;②向溶液中加入过量的氯化钡,把溶液中的硫酸根都转化成沉淀,故②中加入的试剂为BaCl2溶液;③加入过量的碳酸钠溶液,把第二步中过量的氯化钡除去,这样得到的混合液中含有硫酸钡沉淀还有碳酸钠和氯化钠溶液,故③中加入的试剂为Na2CO3溶液;④是过滤操作除去生成的硫酸钡沉淀,故④的操作是过滤;⑤向滤液中加入适量的盐酸,除去过量的碳酸钠溶液,得到纯净的氯化钠溶液,故⑤中加入的试剂为稀盐酸;⑥再通过蒸发结晶操作得到纯净的氯化钠晶体,故⑥的操作是蒸发结晶;
(1)故操作①、②、③、⑤中所需加入试剂分别为:蒸馏水、BaCl2溶液、Na2CO3溶液、稀盐酸;
(2)故操作①、④、⑥的操作名称分别为:溶解、过滤、蒸发结晶;
(3)第②步是加入过量的氯化钡,把溶液中的硫酸根都转化成沉淀,故方程式为:Na2SO4+BaCl2=BaSO4↓+2NaCl;第⑤步是加入适量的盐酸,除去过量的碳酸钠溶液,故方程式为:Na2CO3+2HCl=2NaCl+H20+C02↑
(4)操作④为过滤,需要的玻璃仪器有烧杯、漏斗、玻璃棒等。



