题目内容
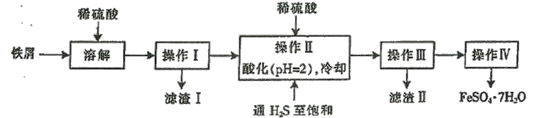
【题目】铁碳微电解技术是利用原电池原理处理酸性污水的一种工艺,装置如图。若上端开口关闭,可得到强还原性的H· (氢原子);若上端开口打开,并鼓入空气,可得到强氧化性的·OH (羟基自由基)。下列说法错误的是( )。
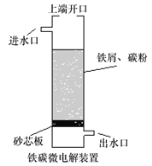
A.无论是否鼓入空气,负极的电极反应式均为Fe-2e-=Fe2+
B.不鼓入空气时,正极的电极反应式为H++e-= H·
C.鼓入空气时,每生成1mol·OH有2mol电子发生转移
D.处理含有草酸(H2C2O4)的污水时,上端开口不需要应打开
【答案】CD
【解析】
A. 无论是否鼓入空气,Fe易失去电子生成Fe2+,作负极;
B. 不鼓入空气时,正极上可得到具有较强还原性的氢原子;
C. 若上端开口打开,并鼓入空气,可得到具有较强氧化性的羟基自由基,O元素化合价从0价变为-1价;
D. 处理含有草酸(H2C2O4)的污水时,因为草酸具有还原性,应该得到强还原性的羟基自由基才能实现。
A. 无论是否鼓入空气,Fe易失去电子生成Fe2+,作负极,电极反应为:Fe-2e-=Fe2+,A项正确,不符合题意;
B. 不鼓入空气时,正极上可得到具有较强还原性的氢原子,电极反应为:H++e-= H,B项正确,不符合题意;
C. 若上端开口打开,并鼓入空气,可得到具有较强氧化性的羟基自由基,O元素化合价从0价变为-1价,因此鼓入空气时,每生成1mol·OH有1mol电子发生转移,C项错误,符合题意;
D. 处理含有草酸(H2C2O4)的污水时,因为草酸具有还原性,应该得到强还原性的羟基自由基才能实现,因此上端开口应打开并鼓入空气,D项错误,符合题意;
答案选CD。

【题目】25℃时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.7×10﹣4molL﹣1 | K1=4.4×10﹣6molL﹣1 K2=5.6×10﹣11molL﹣1 | 3.0×10﹣8 molL﹣1 |
请回答下列问题:
(1)同浓度的CH3COOH、H2CO3、HClO溶液的pH最大的是_____.
(2)常温下0.1molL﹣1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是_____(填字母序号,下同).
A.c(H+)
B.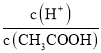
C.c(H+)c(OH﹣)
D.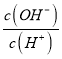
E.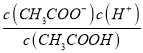
若该溶液升高温度,上述5种表达式的数据增大的是_________.
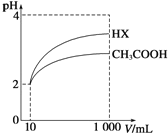
(3)体积为10mL pH=2的醋酸溶液与一元酸HX溶液分别加水稀释至1000mL,稀释过程pH变化如图:则HX的电离平衡常数_____(填“大于”、“等于”或“小于”)醋酸的平衡常数.稀释后,HX溶液中有水电离出来的c(H+)_____(填“大于”、“等于”或“小于”)醋酸的溶液中有水电离出来的c(H+),理由是___________.
(4)已知100℃时,水的离子积为1×10﹣12,该温度下测得某溶液PH=7,该溶液显_____(填“酸”、“碱”或“中”)性.将此温度下PH=1的H2SO4溶液aL与PH=11的NaOH溶液bL混合,若所得混合液PH=2,则a:b=_____.
【题目】某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液,请填写下列空白:
(1)选用的指示剂是______________________。
(2)用标准的盐酸溶液滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视______________________。
(3)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是_______________。
A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(4)若滴定开始和结束时,酸式滴定管中的液面如图所示,请将数据填入下面表格的横线处。
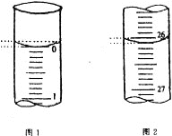
滴定次数 | 待测氢氧化钠溶液的体积/ mL | 0.1000 mol/L 盐酸的体积/ mL | ||
滴定前刻度 | 滴定后刻度 | 溶液体积/ mL | ||
第一次 | 25.00 | 0.00 | ________ | _______ |
第二次 | 25.00 | 2.00 | 28.08 | 26.08 |
第三次 | 25.00 | 0.22 | 26.34 | 26.12 |
(5)请根据上表中数据列式计算该氢氧化钠溶液的物质的量浓度:c(NaOH)= _________。
(6)滴定终点的判定依据是_______________。