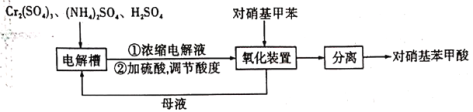
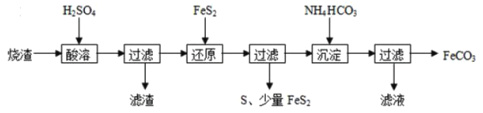
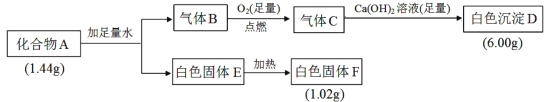
题目内容
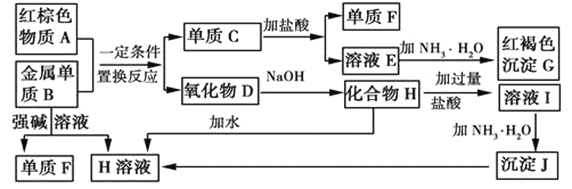
【题目】如图是中学化学中常见物质的转化关系,部分物质和反应条件略去。
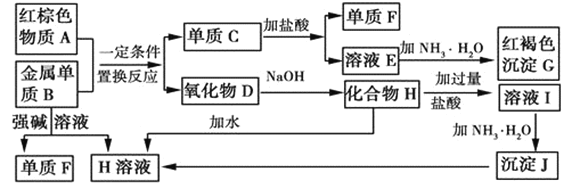
(1)单质F的化学式是___。
(2)写出由沉淀J生成 H溶液的离子方程式__。
(3)溶液E中加入氨水时,先生成白色沉淀L,写出生成L的离子方程式:__,白色沉淀L最终变为红褐色沉淀G,写出L变为G的化学反应方程式__。
(4)溶液I中所含金属离子是__。
【答案】H2 Al(OH)3+OH-=AlO2-+2H2O Fe2++2NH3·H2O=Fe(OH)2↓+2NH4+ 4Fe(OH)2+O2+2H2O=4Fe(OH)3 4Fe(OH)2+O2+2H2O=4Fe(OH)3 Al3+和Na+
【解析】
溶液E与氨水反应生成红褐色沉淀G,可知G是氢氧化铁,则红色物质A是Fe2O3;金属单质B能与强碱溶液反应,B是Al、F是H2、H是NaAlO2;Fe2O3与Al发生铝热反应生成氧化铝和铁,D是Al2O3、C是Fe;Fe与盐酸反应生成FeCl2,则E是FeCl2;NaAlO2与盐酸反应生成氯化钠、氯化铝,氯化铝与氨水反应生成氢氧化铝沉淀,J是Al(OH)3,氢氧化铝与氢氧化钠反应生成偏铝酸钠。
根据以上分析,(1)铝与氢氧化钠反应生成偏铝酸钠和氢气,所以单质F是氢气,化学式是H2。
(2)沉淀J是Al(OH)3,与氢氧化钠反应生成偏铝酸钠溶液,反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O。
(3)溶液E是FeCl2,加入氨水时,生成白色沉淀氢氧化亚铁,反应的离子方程式是Fe2++2NH3·H2O=Fe(OH)2↓+2NH4+,氢氧化亚铁易被氧气氧化为红褐色氢氧化铁沉淀,白色沉淀变为红褐色沉淀的化学反应方程式是4Fe(OH)2+O2+2H2O=4Fe(OH)3。
(4)NaAlO2与盐酸反应生成氯化钠、氯化铝,所以溶液I是中所含金属离子是Al3+和Na+。