题目内容
【题目】对硝基苯甲酸(![]() )是一种广泛用于医药、染料、感光材料等的重要精细化工中间体。工业上以对硝基甲苯(
)是一种广泛用于医药、染料、感光材料等的重要精细化工中间体。工业上以对硝基甲苯(![]() )、Cr(SO)3等物质为主要原料,通过间接电合成法制备对硝基苯甲酸,生产工艺流程如下:
)、Cr(SO)3等物质为主要原料,通过间接电合成法制备对硝基苯甲酸,生产工艺流程如下:
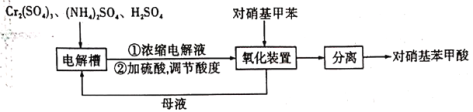
已知:①对硝基甲苯:黄色晶体,熔点为51.7℃,沸点为238.5℃,不溶于水,易溶于乙醇、乙醚、氯仿和苯。②对硝基苯甲酸:黄色晶体,熔点为242℃,沸点为359℃,微溶于水,溶于乙醇,能升华。
回答下列问题:
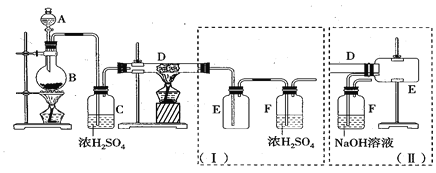
(1)电解制备Cr2O72-:用H型隔膜电解槽电解制备Cr2O72-,装置如下图1所示。外接电源的负极为__(填“A”或“B”),反应II的离子方程式为_______。
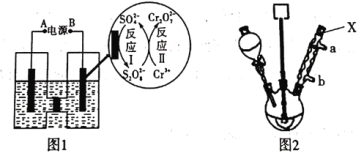
(2)氧化制备对硝基苯甲酸:用上图2所示装置制备对硝基苯甲酸,具体过程如下:
步骤1:向250 mL三颈烧瓶中依次加入一定量含Cr2O72-的电解液、对硝基甲苯,搅拌、水浴升温到设定温度,恒温下进行反应,直至反应液由棕红色变为墨绿色时为止。
步骤2:待反应混合物冷却至室温后,与适量冰水充分混合,抽滤。滤液返回电解槽中重新电解。
步骤3:把步骤2中抽滤所得固体溶于5%的热NaOH溶液中(约60℃),待温度降到50℃时,抽滤,向滤液中加入过量2 mol/L H2SO4,析出黄色沉淀,再抽滤,并用冷水洗涤,然后在低于80℃的条件下烘干,可得粗产品。
①仪器X的名称是_____,冷却水应从___口进入(填“a”或“b”)。
②步骤2中,抽滤所得固体的主要成分是_____。
③步骤3中,用NaOH溶液处理后,需待温度降到50℃时进行抽滤的原因是______。
④制得的粗产品需要进一步纯化,根据对硝基苯甲酸的有关性质可知,对其进行纯化还可以采用_____法完成。
⑤该合成技术的优点是实现了____(填化学式)的循环利用,绿色环保。
(3)测定对硝基苯甲酸的纯度:称取1.670 g粗产品,配成100 mL溶液,取25.00 mL溶液,用0.1000 mol·L-1 KOH溶液滴定,重复滴定四次,每次消耗KOH溶液的体积如下表所示。已知:对硝基苯甲酸的摩尔质量为167.0 g·mol-1,则对硝基苯甲酸的纯度为_____。
第一次 | 第二次 | 第三次 | 第四次 | |
体积( mL) | 23.00 | 23.10 | 21.40 | 22.90 |
【答案】A 3S2O82-+2Cr3++7H2O=6SO42-+Cr2O72-+14H+ 冷凝管 b 对硝基苯甲酸 使未反应的对硝基甲苯凝固析出 升华 Cr2(SO4)3、(NH4)2SO4、H2SO4 92.00%
【解析】
用图1装置电解Cr2(SO4)3、(NH4)2SO4、H2SO4的混合液,获得Cr2O72-的电解液,其中阳极区发生氧化反应,然后将含Cr2O72-的电解液浓缩并加硫酸酸化,再在氧化装置内将对硝基甲苯氧化为对硝基苯甲酸,将反应混合物冷却至室温后,与适量冰水充分混合,抽滤,所得所得固体溶于5%的热NaOH溶液中(约60℃),待温度降到50℃时,抽滤,向滤液中加入过量2 mol/L H2SO4,析出黄色沉淀,再抽滤,并用冷水洗涤,然后在低于80℃的条件下烘干,可得对硝基苯甲酸粗产品,据此分析解题。
(1)电解槽中阳极周围阴离子发生氧化反应,反应Ⅰ是SO42-氧化为S2O82-,则右侧电极为阳极,B为外接电源正极,A为外接电源的负极;反应II是S2O82-氧化Cr3+生成Cr2O72-,发生反应的离子方程式为3S2O82-+2Cr3++7H2O=6SO42-+Cr2O72-+14H+;
(2)①仪器X的名称是冷凝管,冷却水的水流方向应与蒸气流向相反,则应从b口进入冷水;
②步骤1中反应液由棕红色变为墨绿色时,说明有对硝基苯甲酸生成,则步骤2经冷却后,经抽滤所得固体的主要成分是对硝基苯甲酸;
③对硝基甲苯的熔点为51.7℃,则步骤3中,用NaOH溶液处理后,需待温度降到50℃时进行抽滤,目的是使未反应的对硝基甲苯凝固析出,可提高对硝基苯甲酸的纯度;
④对硝基苯甲酸是黄色晶体,能升华,则对粗产品进行纯化还可以采用升华法完成;
⑤由工业流程图可知,步骤2中抽滤后的滤液返回电解槽中重新电解,说明滤液中的Cr2(SO4)3、(NH4)2SO4、H2SO4可循环利用,符合绿色环保;
(3)第三次实验消耗KOH的体积明显偏小,舍去,其它三次消耗KOH溶液体积的平均值![]() mL=23.00mL,对硝基苯甲酸与KOH溶液发生中和反应时,对硝基苯甲酸与KOH等物质的量反应,则对硝基苯甲酸的纯度为
mL=23.00mL,对硝基苯甲酸与KOH溶液发生中和反应时,对硝基苯甲酸与KOH等物质的量反应,则对硝基苯甲酸的纯度为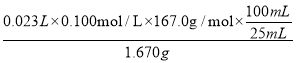 ×100%=92.0%。
×100%=92.0%。

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案